УРАН (лат. Uranium)
U, радиоактивный хим. элемент III гр. периодич. системы, ат. н. 92, ат. м. 238,0289;
относится к ак-тиноидам. Стабильных изотопов не имеет. Известно 16 изотопов
с мас. ч. 226-240, 242; наиб. долгоживущие изотопы 234U (Т1/2
2,45·105 лет, a-излучатель), 235U (T1/2
7,04·108 лет, a-излучатель) - родоначальник радиоактивного ряда
(4n + 3) и 238U (Т1/24,47·109
лет, a -излучатель)- родоначальник радиоактивного ряда (4n + 2). Прир.
смесь изотопов содержит 99,275% 238U, 0,720% 235U, 0,005%
234U. Поперечное сечение захвата тепловых нейтронов 233U
4,6·10-27 м2, 235U 9,8 · 10-27 м2,
238U 2,7 · 10-28 м2; сечение деления 233U
5,27·10-26 м2, 235U 5,84·10-26 м2,
прир. смеси изотопов 4,2·10-28 м2. Конфигурация внеш.
электронных оболочек атома 5f36s26p66d17s2>r;
степени окисления +2, +3, +4, +5, +6 (наиб. устойчивая); электроотрицательность
по Полингу 1,22; ат. радиус 0,156 нм, ионные радиусы U3+ 0,1024 нм,
U4+ 0,089 нм, U5+ 0,088 нм и U6+ 0,083 нм.
Среднее содержание U в
земной коре 3 · 10-4% по массе. В слое литосферы толщиной 20 км содержится
~ 1014 т, в морской воде 109-1010 т. Важнейшие
минералы: настуран U3O8 уранинит (U, Th)O2,
урановая смоляная руда (оксиды UO2,0-UO2,67), карнотит
K2[(UO2)2(VO4)2]·3H2O,
тюямунит Ca[(UO2)2(VO4)2]·8H2O.
Пром. значение имеют также тита-наты, напр. браннерит UTi2O6,
силикаты - коффинит U[SiO4]1-x(OH)4x, танталониобаты
и гидритированные фосфаты и арсенаты уранила - урановые слюдки. Крупные месторождения
урана находятся в Канаде, ЮАР, США, Австралии, Франции и др. странах.
Свойства. Уран- серебристо-белый
блестящий металл. Ниже 669 0C устойчива a-форма с ромбич. решеткой,
а = 0,2854 нм, b = 0,5869 нм, с =0,4956 нм, z = 4,
пространств. группа Cmcm, плотн. 19,12 г/см3; в интервале
669-776 0C устойчива 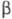 -форма
с тетрагон, решеткой, а =1,0758 нм, с = 0,5656 нм, z =
30, пространств, группа P42/mnm, плотн. 18,11 г/см3;
выше 776 0C существует
-форма
с тетрагон, решеткой, а =1,0758 нм, с = 0,5656 нм, z =
30, пространств, группа P42/mnm, плотн. 18,11 г/см3;
выше 776 0C существует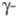 форма
с объемноцентрированной кубич. решеткой, а = 0,3525 нм, z = 2,
пространств. группа Im3m, плотн. 18,06 г/см3;
форма
с объемноцентрированной кубич. решеткой, а = 0,3525 нм, z = 2,
пространств. группа Im3m, плотн. 18,06 г/см3; 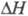 перехода
перехода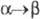 2,78
кДж/моль,
2,78
кДж/моль, 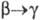 4,73
кДж/моль. T. пл. 1135 С, т. кип. ок. 4200 0C; рентгеновская плотн.
4,73
кДж/моль. T. пл. 1135 С, т. кип. ок. 4200 0C; рентгеновская плотн.
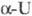 19,16 г/см3;
С°p 27,67 Дж/(моль·К);
19,16 г/см3;
С°p 27,67 Дж/(моль·К); 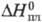 8,72 кДж/моль,
8,72 кДж/моль,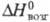 446,7 кДж/моль; S0298 50,20 Дж/(моль·К); ур-ние температурной
зависимости давления пара lgp (мм рт. ст.)= = -25230/Г+5,71 (1980-2420
К);
446,7 кДж/моль; S0298 50,20 Дж/(моль·К); ур-ние температурной
зависимости давления пара lgp (мм рт. ст.)= = -25230/Г+5,71 (1980-2420
К); 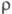 28 мкОм·см;
теплопроводность 0,29 Вт/(см·К) при 343 К; температурный коэф. линейного расширения
28 мкОм·см;
теплопроводность 0,29 Вт/(см·К) при 343 К; температурный коэф. линейного расширения
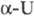 6,8·10-6K-1
(573 К), 9,2·10-6K-1 (773 К); модуль упругости 1758 ГПа;
6,8·10-6K-1
(573 К), 9,2·10-6K-1 (773 К); модуль упругости 1758 ГПа;
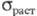 0,344-1,379
ГПа (25 0C), 186,2 МПа (150 0C), 82,7 МПа (600 0C);
модуль сдвига 73,1 ГПа; коэф. Пуассона 0,25; коэф. сжимаемости 97,9 ГПа; модуль
упругой деформации 0,176 кПа; твердость по Виккерсу 200-300 при комнатной т-ре.
При облучении нейтронами урановых блоков изменяются их размеры и форма, ухудшаются
мех. св-ва в связи с накоплением продуктов деления урана. Уран слабо парамагнитен,
магн. восприимчивость+ 1,6·10-6.
0,344-1,379
ГПа (25 0C), 186,2 МПа (150 0C), 82,7 МПа (600 0C);
модуль сдвига 73,1 ГПа; коэф. Пуассона 0,25; коэф. сжимаемости 97,9 ГПа; модуль
упругой деформации 0,176 кПа; твердость по Виккерсу 200-300 при комнатной т-ре.
При облучении нейтронами урановых блоков изменяются их размеры и форма, ухудшаются
мех. св-ва в связи с накоплением продуктов деления урана. Уран слабо парамагнитен,
магн. восприимчивость+ 1,6·10-6.
Уран очень реакционноспособен,
взаимод. с большинством простых B-B, на воздухе покрывается черной пленкой урана
оксидов, порошкообразный уран пирофорен. Реагирует с водой, быстро раств.
в соляной и азотной к-тах, медленно - в H2SO4, H3PO4,
фтористоводородной к-те, образуя соли уранила UO2+2.
В водных р-рах уран может
существовать в степенях окисления от +3 до +6. Стандартные окислит. потенциалы
для U(IV)/U(IID -0,52 В, U(V)/U(IV) 0,38 В, U(VI)/U(V) 0,17 В, U(VI)/U(IV) 0,27
В. Для бесконечно разб. водных р-ров DH0обр ионов:
-489 (U3+), -591 (U4+), -1032 (UO2+
), -1019 кДж/моль (UO2+2). Ион U3+ неустойчив,
разлагает воду с образованием H2 и U4+, образуется из
U4+ под действием сильных восстановителей (напр., порошка Zn) или
при элек-трохим. восстановлении; U4+ устойчив в отсутствии воздуха,
медленно окисляется воздухом до UO2+2, гидролизуется,
образуется в р-рах UO2+2 под действием восстановителей
средней силы (напр., Na2S2O6, Pb) или электрохимически;
UO+2 неустойчив, быстро диспропорционирует на U4+
и UO22+, наиб. устойчив при рН 2-4, образуется при восстановлении
UO2+ амальгамой Zn, H2 или электрохимически;
UO22+ наиб, устойчивое состояние. Уран в р-рах гидролизуется
при рН > 3. Ионы урана в р-рах имеют характерную окраску: U3+ - красную,
U4+ -зеленую, UO22+ - желтую. Склонность к
гидролизу и комплек-сообразованию уменьшается в ряду U4+ > UO22+
> U3+ > UO2+. Плохо растворимые в воде
соли урана- фосфат, ванадат, сульфид, 8-гидроксихинолинат и др., а также диуранаты
щелочных металлов (соли диурановой к-ты H2U2O7)
используются для выделения UO22+ из р-ров; иодат, фторид,
оксалат, купферо-нат, фениларсонат - для выделения из р-ров U4+.
При нагр. урана в атмосфере
H2 при 250-350 0C образуется тригидрид UH3
(табл. 1), к-рый раств. в воде, HNO3 и конц. соляной и серной к-тах,
не раств. в р-рах щелочей и аммиака; пирофорен: взрывается в смеси с CCl4:
при нагр. выделяет H2; применяется для получения тонкодисперсного
урана.
Уран образует простые галогениды
UHaIn (п = 3, 4, 5, 6), оксигалогениды UOHaIn (п=1,
2, 3) и уранилгалогсниды UO2HaIn (п = 1, 2), а
также комплексные и смешанные галогениды (табл. 2). Наиб, важные из них - урана
фториды. Трихлорид UCl3, трибромид UBr3 и тrииодид
UI3 синтезируют взаимод. UH3 при 350 0C соотв.
с HCl, HBr и HI: UCl3 получакп также р-цией избытка UCl4
с Al или Zn при 400 0C с послед, отгонкой AlCl3 или ZnCl2
и остатка UCl4. Тетрахлорид UCl4 синтезируют взаимод.
UO2, с CCl4, COCl2, S2Cl2.,
SO2Cl2, или РCl5, тетрабrомид UBr4
и тетраиодид UI4 - р-цией U соотв. с Br2 и I2.
Соед. UCl4, UBr4 и UI4 весьма гигроскопичны,
легко раств. в воде и полярных орг. р-рителях и не раств. в неполярных орг.
р-рителях.
Табл. 1.- ХАРАКТЕРИСТИКА
НЕКОТОРЫХ СОЕДИНЕНИЙ УРАНА
|
Показатель |
|
UB2 |
UB4 |
UB12 |
U3Si2 |
|
US |
|
UP |
||
|
Цвет |
Серебристо-серый |
Серебристо-серый |
Серебристо-серый |
От коричневого
до черного |
Светло-серый |
Серо-черный |
Серо-черный |
Серый, черный |
|||
|
Сингония |
Кубич. |
Гексагон. |
Тетрагон. |
Кубич. |
Тетрагон. |
Тетрагон. |
Кубич. |
Ромбич. |
Кубич. |
||
|
Параметры решетки,
нм: |
|
|
|
|
|
|
|
|
|
||
|
а |
0,4160 |
0,31293 |
0,7075 |
0,44773 |
0,73299 |
0,398 |
0,54903 |
0,44803 |
0,55889 |
||
|
с |
— |
0,3989 |
0,3979 |
— |
0,39004 |
0,1374 |
— |
0,7439 |
— |
||
|
Пространств. группа |
Pm3n |
P6/mmm |
P4/mbm |
Fm3m |
Р4/тbт |
— |
Рт3т |
Рbab |
Fm3m |
||
|
T. пл., 0С |
1006 |
2385 |
2495 |
2145 |
1667 |
1700 |
2462 |
1680 |
2850 |
||
|
Плотн.а,
г/см3 |
11,12 |
12,82 |
9,32 |
5,65 |
11,31 |
— |
10,87 |
8,09 |
10,23 |
||
|
|
- 126,99 |
- 164,3 (1770 К) |
— |
- 252,5 (2060 К) |
- 170,5 |
- 129,6 |
-314,3 |
— |
-262,1 |
||
а Рентгеновская.
6 Т-ра перехода в др. кубич. форму с плотн. 10,92 г/см3.
вИзвестна также гексаген, форма. г Наиб,
устойчива; существует также тетрагон, и гексаген. (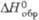 - 525,0 кДж/моль) модификации.
- 525,0 кДж/моль) модификации.
Табл. 2.- ХАРАКТЕРИСТИКА
ГАЛОГЕНИДОВ УРАНА
|
Показатель |
UCl3 |
UCl4 |
|
|
UCl6 |
UBr3 |
UBr4 |
UBr5 |
UI3 |
UI4 |
||
|
Цвет |
Оливково-зеленый |
Зеленый |
Красно -коричневый |
Коричневый |
Темно-зеленый |
Красновато-коричневый |
Темно-коричневый |
— |
Черный |
Черный |
||
|
Сингония |
Гексагон. |
Тетрагон.a |
Моноклинная |
Триклинная |
Гексагон. |
Гексагон. |
Моноклинная |
Триклинная |
Ромбич. |
— |
||
|
Параметры решетки,
нм: |
|
|
|
|
|
|
|
|
|
|
||
|
a |
0,7442 |
0,8296 |
0,799 |
0,709 |
1,090 |
0,7936 |
1,092 |
0,7449 |
0,4328 |
— |
||
|
в |
— |
— |
1,069 |
0,966 |
— |
— |
0,869 |
1,0127 |
1,3996 |
— |
||
|
с |
0,4320 |
0.7481 |
0,848 |
0,636 |
0,603 |
0,4438 |
0,705 |
0,6686 |
0,9984 |
— |
||
|
угол, град |
— |
— |
91,5 |
88,5 (a), 117,6
(b), 108,5 (g) |
— |
— |
93,15 |
89,25 (a), 117,56
(b), 108,87 (g) |
— |
— |
||
|
Число формульных
единиц в ячейке |
2 |
4 |
4 |
— |
3 |
2 |
— |
— |
4 |
— |
||
|
Пространств. группа |
рб3/т |
I4/amd |
Р21п |
P1 |
СЗт |
P63/m |
_ |
P1 |
Стст |
_ |
||
|
T. пл., 0C |
841 |
590б |
327 |
— |
177,5 |
730в |
519г |
— |
788 |
520д |
||
|
Плотн., г/см3 |
5,51 |
4,87 |
— |
— |
3,59 |
6,55 |
— |
— |
6,76 |
— |
||
|
|
102,8 |
121,85 |
150,62 |
— |
175,6 |
105,3 |
130,8 |
— |
— |
— |
||
|
|
- 866,5 |
-1017,8 |
- 1035,4 |
— |
-1093,9 |
-648,7 |
- 800,9 |
-811,8 |
-441,8 |
- 508,7 |
||
|
|
158,92 |
197,05 |
242,67 |
— |
285,33 |
178 |
242 |
— |
238 |
284 |
||
|
|
237,4 |
199,0 |
170,1 |
— |
74,9 |
307,2 |
224,9 |
— |
— |
229,1 |
||
аПри
547 0C полиморфный переход, DH перехода 11,7 кДж/моль. 6
DHПЛ 49,91 кДж/моль (590 0C). в DHПЛ
46,0 кДж/моль (730 0C). г DHпл
71,69 кДж/моль (519 0C); т. кип. 765 0C, DHисп
126,2 кДж/моль (765 0C). д DHпл
23,58 (788 0С).
Пентахлорид UCl5
раств. в CCl4, CS2 и тионилхлориде, взаимод. с эфирами,
спиртами, кетонами и др. орг. р-рителя-ми: образуется при обработке UCl4
газообразным Cl2 при 500 0C, при взаимод. UO3
(или U3O8) с CCl4 при 250 С. Пентабромид UBr5
получают при взаимод. U с Br2 в присут. катализатора - ацетонитрила.
Гексахлорид UCl6 гидролизуется влагой воздуха, бурно реагирует с
водой, раств. в CCl4 и CHCl3, не раств. в бензоле; получают
диспропорци-онированием UCl5 при 120-150 0C в высоком
вакууме.
Боrиды: UB2,
UB4, UB12 не раств. в воде. UB2 разлагается
конц. HNO3, фтористоводородной к-той, H2O2;
получают взаимод. U с В выше 1700 0C. UB4 раств. в HNO3
и фтористоводородной к-те, в кипящей конц. H2SO4; получают
электролизом расплава U3O8 и H3BO3
при 1000 0C. UB12 раств. в смеси HNO3 и H2O2,
горячей конц. H2SO4, не раств. в горячих конц. соляной
и азотной к-тах.
Силициды: U3Si,
U3Si2, USi, U3Si5, USi2,
USi3. Соед. U3Si2 и USi2 не раств.
в воде и неорг. к-тах; получают из U и Si при высоких т-рах: U3Si2
перспективен как компонент твэлов; USi2, обогащенный 235U,-
перспективное ядерное топливо.
Сульфиды: U2S3,
U3S5, US2, US3, US. Сульфиды US
и US2 не раств. в воде, разлагаются неорг. к-тами, US в атмосфере
O2 воспламеняется при 375 0C: получают взаимод. U c S
или H2S с послед, гомогенизацией при 1800 0C.
Фосфиды: UP, U3P4,
UP2. Фосфид UP устойчив к окислению и гидролизу; не раств. в воде,
разб. соляной к-те, разлагается кипящей HNO3, царской водкой; получают
из простых B-B при 500-600 0C с послед, гомогенизацией при 1000 0C
или взаимод. порошка U с PH3 при 500 0C; UP, обогащенный
235U,- перспективное ядерное топливо.
Известны соед. урана с Ge,
Sn, Pb, Те и др. См. также Урана карбиды, Урана нитриды, Уранаты, Уранорганичесше
соединения.
Получение. Технология
урана тесно связана с урановым топливным циклом (см. Ядерный топливный цикл)и состоит из четырех составных частей, отличающихся изотопным составом перерабатываемых
B-B и целями переработки. Производят: соед. урана с прир. соотношением изотопов
(цель концен-трирование и очистка, подготовка к разделению изотопов или произ-ву
Pu); соед., обогащенные изотопом 235U (цель -ироиз-во твэлов ядерных
энергетич. установок в виде диоксида или сплавов урана, а также ядерного оружия):
соед., обедненные изотопом 235U (цель - безопасное хранение, применение
вне энергетики): соед., полученные из облученного ядерного горючего (т. наз.
радиохим. произ-во, цель - отделение от Pu и Np, очистка от продуктов деления,
подготовка к разделению изотопов и повторному изготовлению твэлов). Кроме того,
создаются основы технологии урана применительно к уран-ториевому ядерному топливному
циклу (высокотемпературные газовые ядерные реакторы с топливом из 232Th
и 233U в виде смешанных диоксидов или карбидов) и к уран-плутониевому
циклу (реакторы на быстрых нейтронах с топливом из 239Pu и 238U
в виде смешанных диоксидов).
Переработка природных соед.
урана включает обогащение руд (получение рудных концентратов), ураново-рудный передел
(получение хим. концентратов), аффинаж (получение чистых соед. урана, в частности
UF4), сублиматное (гексафторидное) и металлургич. произ-ва. Для обогащения
руд используют радиометрич., гравитационные, реже флотац. методы, магн. сепарацию
(см. Обогащение полезных ископаемых}. Рудные концентраты обычно подвергают
выщелачиванию с добавкой окислителей (MnO2, NaClO3, H2SO4
и др.), концентрируют уран с помощью ионообменной сорбции, осаждают диура-наты
водным р-ром NaOH или NH3 и прокаливают до U3O8 (хим.
концентрат). Рудные концентраты с высоким содержанием карбонат-ионов выщелачивают
р-рами Na2CO3. Этот процесс, а также сернокислотное выщелачивание
сульфидсо-держащих руд часто проводят под давлением в автоклавах, используя
в качестве окислителя O2. Все большее значение приобретает экологически
и экономически более выгодное подземное и кучное выщелачивание. В заметных масштабах
извлекают уран при переработке фосфатных руд, в частности экстракцией из техн.
H3PO4, а также сорбцией из морской и др. прир. вод.
Для аффинажа урана применяют
методы жидкостной экстракции (обычно трибутилфосфатом из азотнокислых сред),
сочетая их с сорбцией на ионообменной смоле и осаждением в виде уранатов. Очищенные
р-ры солей U(Vl) восстанавливают до U(IV), из них осаждают UF4, к-рый
сушат и прокаливают. По др. способу получают UO3, к-рый восстанавливают
H2 и далее фторируют образовавшийся UO2 газообразным HF.
На сублиматных заводах UF4 фторируют до UF6, на металлургических
- восстанавливают Ca или Mg до металла.
Разделение изотопов урана
проводят методом диффузии UF6 через пористые мембраны или с помощью
центрифуг. Разрабатывают высокоэффективные лазерные методы. Обогащенный изотопом
235U (до содержания не менее 2,5-3,0%) поток UF6 гидролизуют
водными р-рами, осаждают и прокаливают осадок, либо подвергают восстановит,
пирогидролизу влажным H2 до UO2. Обедненный изотопом 235U
(до содержания 0,2-0,4%) UF6 восстанавливают до UF4 и
далее до металла, либо подвергают пирогидролизу до U3O8.
Твэлы после удаления оболочки
растворяют в HNO3, а р-р очищают методом многоступенчатой экстракции
с использованием трибутилфосфата. Очищенный р-р UO2(NO3)2
упаривают, подвергают денитрации и (при необходимости корректировки изотопного
состава) превращают полученные оксиды в UF6. Используют также осаждение
и прокаливание оксалата уранила UO2C2O4·3H2O
или пероксида UO4·2H2O.
Определение. Качественно
уран обнаруживают: по яркой желто-зеленой флуоресценции 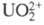 в присут. NaF под действием УФ излучения; по образованию желтой окраски при
добавлении H2O2 к карбонатному р-ру или KCNS к кислым
р-рам; по красно-бурой окраске р-ра в присут. ферроцианида К или 8-гидрооксихинолина
и др.
в присут. NaF под действием УФ излучения; по образованию желтой окраски при
добавлении H2O2 к карбонатному р-ру или KCNS к кислым
р-рам; по красно-бурой окраске р-ра в присут. ферроцианида К или 8-гидрооксихинолина
и др.
Количественно уран определяют:
гравиметрически в виде U3O8, (UO2)2P2O7
и др.: титриметрически - в виде U4+ с использованием для титрования
KMnO4, K2Cr2O7 и др.: фотометрически
- по собств. окраске ионов урана. Субмикрограм-мовые кол-ва урана (10-6-10-10
г) определяют люминесцентным методом. Применяют также электрохим. (полярография,
по-тенциометрия, кулонометрия), радиометрич. (уд. a-активность 235U
и 238U составляет соотв. 0,08 и 0,012 Бк/мкг), нейтронно-активационный
(с использованием нуклидов 239U, 239Np или продуктов деления
урана) и атомно-эмиссионный методы анализа.
Применение. Уран используют
гл. обр. в виде диоксида или сплавов в качестве ядерного топлива в ядерных реакторах
на атомных электростанциях и в двигателях крупных транспортных ср-в (корабли,
атомные лодки). При делении ядер 1 кг 235U выделяется ок. 2·107кВт·ч
энергии. 235U- источник энергии в ядерном оружии. Критич. масса 235U
50 кг (плотн. 19,5 г/см3, критич. радиус 9 см). 238U применяют
для получения 239Pu. 233U - вторичное ядерное топливо.
Обедненный изотопом
235U уран используют в бронебойных снарядах и пулях и др. См. также
Урана сплавы.
Мировая добыча урана в нач.
80-х гг. 20 в. составляла ок. 50 тыс. т в год (без СССР).
Впервые уран в виде UO2
открыл M. Клапрот в 1789, метал-лич. уран получил Э. Пелиго в 1841.
Уран- общеклеточный яд, поражает
все органы и ткани; его действие обусловлено хим. токсичностью и радиоактивностью.
ПДК для растворимых соед. урана 0,015 мг/м3, для нерастворимых - 0.075
мг/м. Осн. мероприятия по борьбе с загрязнением воздушной среды пылью при добыче
и переработке урана: макс, механизация процессов, герметизация оборудования, использование
мокрых способов переработки сырья. MH. операции на радиохим. произ-вах проводят
дистанционно, с применением биол. защиты.
Лит.: Громов Б.
В., Введение в химическую технологию урана, M., 1978; Химия урана, под ред.
Б. H. Ласкорина, M., 1981; Химия урана, под ред. Б. H. Ласкорина, Б. Ф. Мясоедова,
M., 1989; Chemistry of the acunide elements, 2 ed., v. 1, N. Y., 1986,
p. 169-442. Б. Ф. Мясоедов, Э. Г. Раков.
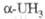
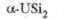

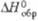 , кДж/
, кДж/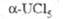

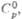 Дж/(моль·К)
Дж/(моль·К)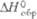 , кДж/
, кДж/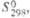 Дж/(моль·К)
Дж/(моль·К)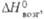 кДж/
кДж/