Ртуть (лат. Hydrargyrum), Hg, химический элемент II группы периодической системы Менделеева, атомный номер 80, атомная масса 200,59; серебристо-белый тяжёлый металл, жидкий при комнатной температуре. В природе ртуть представлена семью стабильными изотопами с массовыми числами: 196 (0,2%), 198 (10,0%), 199 (16,8%), 200 (23,1%), 201 (13,2%), 202 (29,8%), 204 (6,9%).
Историческая справка. Самородная ртуть была известна за 2000 лет до н. э. народам Древней Индии и Древнего Китая. Ими же, а также греками и римлянами применялась киноварь (природная HgS) как краска, лекарственное и косметическое средство. Греческий врач Диоскорид (1 в. н. э.), нагревая киноварь в железном сосуде с крышкой, получил ртуть в виде паров, которые конденсировались на холодной внутренней поверхности крышки. Продукт реакции был назван hydrárgyros (от греч. hýdor — вода и árgyros — серебро), т. е. жидким серебром, откуда произошли латинские названия hydrargyrum, а также argentum vivum — живое серебро. Последнее сохранилось в названиях ртути quicksilver (англ.) и Quecksilber (нем.). Происхождение русского названия ртути не установлено. Алхимики считали ртуть главной составной частью всех металлов. «Фиксация» ртути (переход в твёрдое состояние) признавалась первым условием её превращения в золото. Твёрдую ртуть впервые получили в декабре 1759 петербургские академик И. А. Браун и М. В. Ломоносов. Учёным удалось заморозить ртуть в смеси из снега и концентрированной азотной кислоты. В опытах Ломоносова отвердевшая ртуть оказалась ковкой, как свинец. Известие о «фиксации» ртути произвело сенсацию в учёном мире того времени; оно явилось одним из наиболее убедительных доказательств того, что ртуть — такой же металл, как и все прочие.
Распространение ртути в природе. Ртуть принадлежит к числу весьма редких элементов, её среднее содержание в земной коре (кларк) близко к 4,5×10-6% по массе. Приблизительно в таких количествах она содержится в изверженных горных породах. Важную роль в геохимии ртути играет её миграция в газообразном состоянии и в водных растворах. В земной коре ртуть преимущественно рассеяна; осаждается из горячих подземных вод, образуя ртутные руды (содержание ртути в них составляет несколько процентов). Известно 35 ртутных минералов; главнейший из них — киноварь HgS.
В биосфере ртуть в основном рассеивается и лишь в незначительных количествах сорбируется глинами и илами (в глинах и сланцах в среднем 4×10-5%). В морской воде содержится 3×10-9% ртути.
Самородная ртуть, встречающаяся в природе, образуется при окислении киновари в сульфат и разложении последнего, при вулканических извержениях (редко), гидротермальным путём (выделяется из водных растворов).
Физические и химические свойства. Ртуть — единственный металл, жидкий при комнатной температуре. Твёрдая ртуть кристаллизуется в ромбические сингонии, а = 3,463 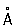 , с = 6,706
, с = 6,706 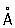 ; плотность твёрдой ртути 14,193 г/см3 (—38,9 °С), жидкой 13,52 г/см3 (20 °С), атомный радиус 1,57
; плотность твёрдой ртути 14,193 г/см3 (—38,9 °С), жидкой 13,52 г/см3 (20 °С), атомный радиус 1,57 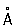 , ионный радиус Hg2+ 1,10
, ионный радиус Hg2+ 1,10 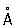 ; tпл — 38,89 °С; tkип 357,25 °С; удельная теплоемкость при 0 °С 0,139 кдж/(кг ×К) [0,03336 кал/(г×°С)]; при 200 °С 0,133 кдж/(кг×К)[0,0319 кал/(г ×°С)]; температурный коэффициент линейного расширения 1,826×10-4 (0—100 °С); теплопроводность 8,247вт/(м×К) [0,0197 кал/(см×сек×°C) (при 20°C); удельное электросопротивление при 0°С 94,07×10-8 ом×м (94,07×10-6 ом×см). При 4,155 К ртуть становится сверхпроводником (см. Сверхпроводимость). Ртуть диамагнитна, её атомная магнитная восприимчивость равна —0,19×10-6 (при 18 °С).
; tпл — 38,89 °С; tkип 357,25 °С; удельная теплоемкость при 0 °С 0,139 кдж/(кг ×К) [0,03336 кал/(г×°С)]; при 200 °С 0,133 кдж/(кг×К)[0,0319 кал/(г ×°С)]; температурный коэффициент линейного расширения 1,826×10-4 (0—100 °С); теплопроводность 8,247вт/(м×К) [0,0197 кал/(см×сек×°C) (при 20°C); удельное электросопротивление при 0°С 94,07×10-8 ом×м (94,07×10-6 ом×см). При 4,155 К ртуть становится сверхпроводником (см. Сверхпроводимость). Ртуть диамагнитна, её атомная магнитная восприимчивость равна —0,19×10-6 (при 18 °С).
Конфигурация внешних электронов атома Hg 5d 106s2, в соответствии с чем при химических реакциях образуются катионы Hg2+ и Hg22+. Химическая активность ртути невелика. В сухом воздухе (или кислороде) она при комнатной температуре сохраняет свой блеск неограниченно долго. С кислородом даёт 2 соединения: чёрную закись Hg2O и красную окись HgO. Hg2O появляется в виде чёрной плёнки на поверхности ртути при действии озона. HgO образуется при нагревании Hg на воздухе (300—350 °С), а также при осторожном нагревании нитратов Hg (NO3)2 или Hg2(NO3)2. Гидроокись ртути практически не образуется. При взаимодействии с металлами, которые ртуть смачивает, образуются амальгамы. Из сернистых соединений важнейшим является HgS, которую получают растиранием Hg с серным цветом при комнатной температуре, а также осаждением растворов солей Hg2+ сероводородом или сульфидом щелочного металла. С галогенами (хлором, иодом) ртуть соединяется при нагревании, образуя почти недиссоциирующие, в большинстве ядовитые соединения типа HgX2. В соляной и разбавленной серной кислотах ртуть не растворяется но растворима в царской водке, азотной и горячей концентрированной серной кислотах.
Почти все соли Hg2+ плохо растворимы в воде. К хорошо растворимым относится нитрат Hg (NO3)2.
Большое значение имеют хлориды ртути: Hg2Cl2 (каломель) и HgCl2 (сулема) Известны соли окисной ртути цианистой и роданистой кислот, а также ртутная соль гремучей кислоты Hg (ONC)2, т. н. гремучая ртуть. При действии аммиака на соли образуются многочисленные комплексные соединения, например HgCI×2NH3 (плавкий белый преципитат) и HgNH2CI (неплавкий белый преципитат). Применение находят ртутьорганические соединения.
Получение ртути. Ртутные руды (или рудные концентраты), содержащие ртуть в виде киновари, подвергают окислительному обжигу
HgS + O2 = Hg + SO2.
Обжиговые газы, пройдя пылеуловительную камеру, поступают в трубчатый холодильник из нержавеющей стали или монель-металла. Жидкая ртуть стекает в железные приёмники. Для очистки сырую ртуть пропускают тонкой струйкой через высокий (1—1,5м) сосуд с 10%-ной HNO3, промывают водой, высушивают и перегоняют в вакууме.
Возможно также гидрометаллургическое извлечение ртути из руд и концентратов растворением HgS в сернистом натрии с последующим вытеснением ртути алюминием. Разработаны способы извлечения ртути электролизом сульфидных растворов.
Применение. Ртуть широко применяется при изготовлении научных приборов (барометры, термометры, манометры, вакуумные насосы, нормальные элементы, полярографы, капиллярные электрометры и др.), в ртутных лампах, переключателях, выпрямителях; как жидкий катод в производстве едких щелочей и хлора электролизом, в качестве катализатора при синтезе уксусной кислоты, в металлургии для амальгамации золота и серебра, при изготовлении взрывчатых веществ (см. Гремучая ртуть); в медицине (каломель, сулема, ртутьорганические и другие соединения), в качестве пигмента (киноварь), в сельском хозяйстве (органические соединения ртути) в качестве протравителя семян и гербицида, а также как компонент краски морских судов (для борьбы с обрастанием их организмами). Ртуть и ее соединения токсичны, поэтому работа с ними требует принятия необходимых мер предосторожности.
С. А. Погодин.
Ртуть в организме. Содержание ртути в организмах составляет около 10-6% В среднем в организм человека с пищей ежесуточно поступает 0,02—0,05 мг ртути. Концентрация ртути в крови человека составляет в среднем 0,023 мкг/мл, в моче — 0,1—0,2 мкг/мл. В связи с загрязнением воды промышленными отходами в теле многих ракообразных и рыб концентрация ртути (главным образом в виде её органических соединений) может значительно превышать допустимый санитарно-гигиенический уровень. Ионы ртути и её соединения, связываясь с сульфгидрильными группами ферментов, могут инактивировать их. Попадая в организм, ртуть влияет на поглощение и обмен микроэлементов — Cu, Zn, Cd, Se. В целом биологическая роль ртути в организме изучена недостаточно.
Ю. И. Раецкая.
Отравления ртутью и её соединениями возможны на ртутных рудниках и заводах, при производстве некоторых измерительных приборов, ламп, фармацевтических препаратов, инсектофунгицидов и др.
Основную опасность представляют пары металлической ртути, выделение которых с открытых поверхностей возрастает при повышении температуры воздуха. При вдыхании ртуть попадает в кровь. В организме ртуть циркулирует в крови, соединяясь с белками; частично откладывается в печени, в почках, селезёнке, ткани мозга и др. Токсическое действие связано с блокированием сульфгидрильных групп тканевых белков, нарушением деятельности головного мозга (в первую очередь, гипоталамуса). Из организма ртуть выводится через почки, кишечник, потовые железы и др.
Острые отравления ртутью и её парами встречаются редко. При хронических отравлениях наблюдаются эмоциональная неустойчивость, раздражительность, снижение работоспособности, нарушение сна, дрожание пальцев рук, снижение обоняния, головные боли. Характерный признак отравления — появление по краю дёсен каймы сине-чёрного цвета; поражение дёсен (разрыхлённость, кровоточивость) может привести к гингивиту и стоматиту. При отравлениях органическими соединениями ртутиь (диэтилмеркурфосфатом, диэтил-ртутью, этилмеркурхлоридом) преобладают признаки одновременного поражения центральной нервной (энцефало-полиневрит) и сердечно-сосудистой систем, желудка, печени, почек.
Лечение: внутривенное введение 20%-ного раствора гипосульфита (12—15 вливаний на курс), унитиол, фармакологические и физиотерапевтические средства, нормализующие высшую нервную деятельность, курортолечение (Пятигорск, Мацеста и т. п.) и др. Профилактика: замена ртути менее вредными веществами, правильные способы хранения, соблюдение мер безопасности при использовании (герметичность оборудования, рациональная отделка помещений, рабочих поверхностей, эффективная вентиляция), индивидуальная защита; предварительные и периодические медицинские осмотры.
Препараты ртути находят применение в медицинской практике, главным образом благодаря их антисептическим и мочегонным свойствам. Как мочегонные применяют меркузал, промеран и др. В качестве антисептиков используют сулему (дезинфекция кожи, одежды, предметов ухода за больными и т. п.), диоцид (стерилизация хирургических инструментов и т. п.), цианид и оксицианид ртути (для промываний и спринцеваний при некоторых воспалительных процессах), амидохлорид ртути (в виде мази при заболеваниях кожи), окись ртути жёлтую (в виде мази при заболеваниях глаз и кожи). Применявшиеся ранее для лечения сифилиса препараты ртути в современной практике не используются.
А. А. Каспаров.
Лит.: Мельников С. М., Ртуть, в кн.: Краткая химическая энциклопедия, т. 4, М., 1965; Реми Г., Курс неорганической химии, пер. с нем., т. 2, М., 1966; Рипан Р., Четяну И., Неорганическая химия, пер. с рум., М., 1972; Некрасов Б. В., Основы общей химии, 2 изд., т. 2, М., 1969; Вредные вещества в промышленности, под общ. ред. Н. В. Лазарева, 6 изд., [ч. 2], Л., 1971; Трахтенберг И. М., Хроническое воздействие ртути на организм, К., 1969; Профессиональные болезни, 3 изд., М., 1973.