Глава 15. Взаимосвязь процессов обмена веществ в организме
Живой организм и его функционирование находятся в постоянной зависимости от окружающей среды. Интенсивность обмена с внешней средой и скорость внутриклеточных процессов обмена веществ поддерживают постоянство внутренней среды и целостность организма.
Как было указано, обмен веществ в организме человека протекает не хаотично; он интегрирован и тонко настроен. Все превращения органических веществ, процессы анаболизма и катаболизма тесно связаны друг с другом. В частности, процессы синтеза и распада взаимосвязаны, координированы и регулируются нейрогормональными механизмами, придающими химическим процессам нужное направление. В организме человека, как и в живой природе вообще, не существует самостоятельного обмена белков, жиров, углеводов и нуклеиновых кислот. Все превращения объединены в целостный процесс метаболизма, подчиняющийся диалектическим закономерностям взаимозависимости и взаимообусловленности, допускающий также взаимопревращения между отдельными классами органических веществ. Подобные взаимопревращения диктуются физиологическими потребностями организма, а также целесообразностью замены одних классов органических веществ другими в условиях блокирования какого-либо процесса при патологии.
Еще Кребс и Корнберг отмечали, что, несмотря на огромное разнообразие пищевых веществ (белки, жиры, углеводы), число химических реакций, обеспечивающих их превращения (распад) и образование энергии, «удивительно мало». Эти закономерности свойственны как организму животных и человека, так и микроорганизмам и растениям.
В настоящее время экспериментально обосновано существование четырех главных этапов распада молекул углеводов, белков и жиров, которые интегрируют образование энергии из основных пищевых источников. На I этапе полисахариды расщепляются до моносахаридов (обычно гексоз); жиры распадаются на глицерин и высшие жирные кислоты, а белки – на составляющие их свободные аминокислоты. Следует подчеркнуть, что указанные процессы в основном являются гидролитическими, поэтому освобождающаяся в небольшом количестве энергия почти целиком используется организмами в качестве тепла.
На II этапе мономерные молекулы (гексозы, глицерин, жирные кислоты и аминокислоты) подвергаются дальнейшему распаду, в процессе которого образуются богатые энергией фосфатные соединения и ацетил-КоА. В частности, при гликолизе гексозы расщепляются до пировиноград-ной кислоты и далее до ацетил-КоА. Этот процесс сопровождается образованием ограниченного числа богатых энергией фосфатных связей путем субстратного фосфорилирования. На этом этапе высшие жирные кислоты аналогично распадаются до ацетил-КоА, в то время как глицерин окисляется по гликолитическому пути до пировиноградной кислоты и далее до ацетил-КоА. Для аминокислот ситуация на II этапе несколько отлична. При преимущественном использовании аминокислот в качестве источника энергии (при дефиците углеводов или при сахарном диабете) некоторые из них непосредственно превращаются в метаболиты лимоннокислого цикла (глутамат, аспартат), другие – опосредованно через глутамат (пролин, гистидин, аргинин), третьи – в пируват и далее в ацетил-КоА (аланин, серин, глицин, цистеин). Наконец, ряд аминокислот, в частности лейцин, изо-лейцин, расщепляется до ацетил-КоА, а из фенилаланина и тирозина, помимо ацетил-КоА, образуется оксалоацетат через фумаровую кислоту. Как видно, II этап можно назвать этапом образования ацетил-КоА, являющегося по существу единым (общим) промежуточным продуктом катаболизма основных пищевых веществ в клетках.
На III этапе ацетил-КоА (и некоторые другие метаболиты, например α-кетоглутарат, оксалоацетат) подвергаются окислению («сгоранию») в цикле ди- и трикарбоновых кислот Кребса. Окисление сопровождается образованием восстановленных форм НАДН + Н+ и ФАДН2.
На IV этапе осуществляется перенос электронов от восстановленных нуклеотидов на кислород (через дыхательную цепь). Он сопровождается образованием конечного продукта – молекулы воды. Этот транспорт электронов сопряжен с синтезом АТФ в процессе окислительного фосфо-рилирования (см. главу 9).
Необходимо отметить, что, помимо взаимных переходов между разными классами веществ в организме, доказано существование более сложных форм связи. В частности, интенсивность и направление любой химической реакции определяются ферментами, т.е. белками, которые оказывают непосредственное влияние на обмен липидов, углеводов и нуклеиновых кислот. В свою очередь синтез любого белка-фермента требует участия ДНК и всех 3 типов рибонуклеиновых кислот: тРНК, мРНК и рРНК. Если к этому добавить влияние гормонов, а также продуктов распада какого-либо одного класса веществ (например, биогенных аминов) на обмен других классов органических веществ, то становятся понятными удивительная согласованность и координированность огромного разнообразия химических процессов, совершающихся в организме. Многие из этих процессов были подробно освещены при описании обмена отдельных классов веществ (см. главы 10-12). В данной главе кратко представлены примеры взаимных переходов отдельных структурных элементов белков, жиров, углеводов (рис. 15.1) и нуклеиновых кислот в процессе их превращений и обмена.
Помимо прямых переходов метаболитов этих классов веществ друг в друга, существует тесная энергетическая связь, когда энергетические потребности могут обеспечиваться окислением какого-либо одного класса органических веществ при недостаточном поступлении с пищей других. Важность белков (в частности, ферментов, гормонов и др.) в обмене всех типов химических соединений слишком очевидна и не требует доказательств. Ранее было отмечено большое значение белков и аминокислот для синтеза ряда специализированных соединений (пуриновые и пиримиди-новые нуклеотиды, порфирины, биогенные амины и др.). Кетогенные аминокислоты, образующие в процессе обмена ацетоуксусную кислоту (ацетоацетил-КоА), могут непосредственно участвовать в синтезе жирных кислот и стеринов. Аналогично могут использоваться гликогенные аминокислоты через ацетил-КоА, но после предварительного превращения в пируват. Некоторые структурные компоненты специализированных липидов, в частности фосфоглицеринов, имеют своим источником аминокислоты и их производные, например серин, этаноламин, сфингозин и холин. Необходимо подчеркнуть, что превращение углеродных скелетов кетогенных или гликогенных аминокислот в жирные кислоты является необратимым процессом, хотя нельзя исключить возможности частичного синтеза глутамата и опосредованно других аминокислот из продуктов распада жирных кислот – ацетил-КоА – через цикл трикарбоновых кислот, включающий α-кетоглутарат. В то же время из глицерина нейтральных жиров через пируват полностью осуществляется синтез углеродных скелетов некоторых гликогенных аминокислот.
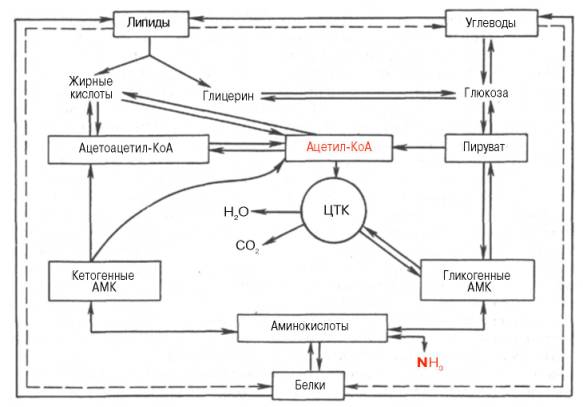
Рис. 15.1. Взаимосвязь белков, жиров и углеводов.
Продукты гидролиза пищевых и тканевых триацилглицеролов, в частности высшие жирные кислоты, участвуют непосредственно в образовании сложных белков – липопротеинов плазмы крови. В составе липопротеинов, являющихся, таким образом, транспортной формой жирных кислот, они доставляются в органы-мишени, в которых жирные кислоты служат или источником энергии (сердечная и поперечно-полосатая мускулатура), или предшественниками синтеза тканевых триацилглицеролов с последующим их отложением в клетках ряда органов (депо липидов).
Получены доказательства синтеза глюкозы из большинства аминокислот. Для некоторых аминокислот (аланин, аспарагиновая и глутами-новая кислоты) связь с глюконеогенезом является непосредственной, для других она осуществляется через побочные метаболические пути. Следует особо подчеркнуть, что три α-кетокислоты (пируват, оксалоацетат и кето-глутарат), образующиеся соответственно из аланина, аспартата и глу-тамата, не только служат исходным материалом для синтеза глюкозы, но являются своеобразными кофакторами при распаде ацетильных остатков всех классов пищевых веществ в цикле Кребса для получения энергии.
Синтез незаменимых аминокислот из продуктов обмена углеводов и жиров в организме животных отсутствует. Клетки животных не содержат ферментных систем, катализирующих синтез углеродных скелетов этих аминокислот. В то же время организм может нормально развиваться исключительно при белковом питании, что также свидетельствует о возможности синтеза углеводов из белков. Процесс синтеза углеводов из аминокислот получил название глюконеогенеза. Он доказан прямым путем в опытах на животных с экспериментальным диабетом: более 50% введенного белка превращается в глюкозу. Как известно, при диабете организм теряет способность утилизировать глюкозу, и энергетические потребности покрываются за счет окисления аминокислот и жирных кислот. Доказано также, что исходными субстратами для глюконеогенеза являются те аминокислоты, распад которых сопровождается образованием прямо или опосредованно пировиноградной кислоты (например, аланин, серин, треонин и цистеин). Более того, имеются доказательства существования в организме своеобразного циклического процесса – глюкозоаланинового цикла, участвующего в тонкой регуляции концентрации глюкозы в крови в тех условиях, когда в период между приемами пищи организм испытывает дефицит глюкозы. Источниками пирувата при этом являются указанные аминокислоты, образующиеся в мышцах при распаде белков и поступающие в печень, в которой они подвергаются дезами-нированию. Образовавшийся аммиак в печени обезвреживается, участвуя в синтезе мочевины, которая выделяется из организма. Дефицит мышечных белков затем восполняется за счет поступления аминокислот пищи.
Энергетическая ценность пищи оказывает определенное влияние на белковый обмен, контролируемый азотистым балансом. Так, если потребляемая энергия пищи ниже минимального уровня, то наблюдается увеличение экскреции азота, и, наоборот, при увеличении энергетической ценности пищи экскреция азота с мочой снижается.
Между циклом лимонной кислоты и орнитиновым циклом мочевино-образования имеются сложные связи, определяющие в известной степени скорость реакций, зависимую от энергетических потребностей клетки и концентраций конечных продуктов метаболизма. Как было показано (см. главу 12), фумаровая кислота образуется в процессе распада аргинино-янтарной кислоты, синтез которой в свою очередь требует наличия аминокислоты аспартата. Образовавшаяся фумаровая кислота (из предшественника аминокислоты аспартата) далее вступает в цикл лимонной кислоты и под действием двух ферментов этого цикла: фумаратгидратазы и малат-дегидрогеназы – превращается в оксалоацетат, который при участии специфической трансаминазы вновь превращается в аспартат, т.е. получается своеобразный аспартат-аргининоянтарный шунт цикла лимонной кислоты, соединенного с циклом мочевинообразования (рис. 15.2). Таким образом, при помощи этого необычного сцепленного механизма происходит переплетение реакций обоих циклов (мочевинообразования и ди- и трикар-боновых кислот). Этот механизм получил название «велосипед Кребса» (The "Krebs bicycle").
Из приведенной общей схемы (см. рис. 15.1) видно также, что имеются различные пути взаимопревращений жиров и углеводов. Практика откорма сельскохозяйственных животных давно подтвердила возможность синтеза жиров из углеводов пищи. С энергетической точки зрения, превращение углеводов в жиры следует рассматривать как накопление и депонирование энергии, хотя синтез жира сопровождается затратой энергии, которая вновь освобождается при окислении жиров в организме. Глицерин, входящий
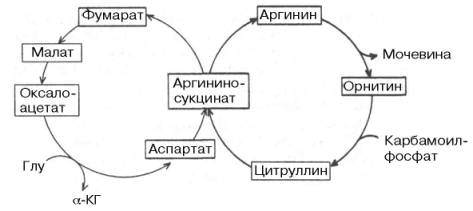
Рис. 15.2. The "Krebs Bicycle". (Печатается с любезного разрешения д-ра David L. Nelson и д-ра М.М. Сох, 1993.)
в состав триацилглицеролов и фосфоглицеринов, может легко образоваться из промежуточных метаболитов гликолиза, в частности из глицераль-дегид-3-фосфата. Следует, однако, подчеркнуть, что основным путем превращения углеводов в жиры является путь образования высших жирных кислот из ацетил-КоА, который образуется при окислительном декар-боксилировании пирувата. Последняя реакция практически необратима, поэтому образования углеводов из высших жирных кислот почти не происходит. Таким образом, синтез углеводов из жиров в принципе может происходить только из глицерина, хотя в обычных условиях реакция протекает в обратную сторону, т.е. в сторону синтеза жиров из глицерина, образующегося при окислении углеводов. Ацетил-КоА, образующийся в процессе обмена углеводов, жиров и ряда аминокислот, служит пусковым субстратом как для синтеза жирных кислот (а следовательно, и липидов вообще), так и для цикла трикарбоновых кислот. Для окисления ацетил-КоА в этом цикле требуется оксалоацетат, который является вторым ключевым субстратом в цикле Кребса. Оксалоацетат может синтезироваться из пировиноградной кислоты и СО2 благодаря реакции карбокси-лирования или образоваться из аспарагиновой кислоты в процессе транс-аминирования с α-кетоглутаратом. Две молекулы ацетил-КоА, конденсируясь, образуют ацетоуксусную кислоту (ацетоацетат), которая является источником других кетоновых тел в организме, в частности β-оксимасляной кислоты (β-оксибутирата) и ацетона (см. главу 11). Следует подчеркнуть, что ацетоуксусная и β-оксимасляная кислоты часто рассматриваются как транспортные формы активной уксусной кислоты, доставляющие ее для окисления в цикле Кребса в периферических тканях. Эти же реакции конденсации двух молекул ацетил-КоА составляют начальные этапы синтеза холестерина, в свою очередь являющегося предшественником гормонов стероидной природы, витамина D3, а также желчных кислот. Последние в виде парных желчных кислот выполняют важную функцию эмульгаторов при переваривании липидов пищи в кишечнике, а также функцию транспортеров, способствуя всасыванию высших жирных кислот. Следует указать также на использование галактозы и частично глюкозы для биосинтеза цереброзидов и гликолипидов, выполняющих важные и специфические функции в деятельности ЦНС. В этом синтезе участвуют не свободные моносахариды, а гексозамины (галактозамин и глюкозамин), биосинтез которых в свою очередь требует доставки амидного азота глутамина, интегрируя тем самым обмен углеводов, липидов и белков.
В последние годы накоплено немало экспериментальных данных, свидетельствующих о существовании в живых организмах множества регулирующих механизмов, осуществляющих метаболический контроль и обеспечивающих как взаимопревращения белков, липидов и углеводов, так и интеграцию энергии. Не отрицая значение других типов регуляции метаболизма (см. главы 8, 9), следует подчеркнуть, что движущей силой во взаимопревращениях веществ и интенсивности метаболизма, вероятнее всего, является энергетическое состояние клетки, в частности уровень АТФ (точнее, отношение АМФ/АТФ). Так, при низких концентрациях АМФ и высоких концентрациях АТФ (состояние, которое принято обозначать «энергонасыщенностью») в клетках происходит резкое снижение глико-литического распада глюкозы, обусловленное действием этих нуклеотидов на ключевой фермент гликолиза – фосфофруктокиназу и на фосфатазу фруктозо-6-фосфата. В результате в клетках накапливается не только фруктозо-6-фосфат, но и его предшественник – глюкозо-6-фосфат. Последний, являясь положительным модулятором фермента гликогенсинтазы, стимулирует синтез полисахарида – гликогена. При низких концентрациях АТФ (соответственно при высоком уровне АМФ) в клетках отмечаются стимулирование гликолиза и окисление пирувата в лимоннокислом цикле, что способствует обеспечению клеток энергией. Однако при низких концентрациях АМФ имеет место снижение скорости цикла трикарбоновых кислот, обусловленное торможением активности изоцитратдегидрогеназы, соответственно наблюдается снижение скорости синтеза АТФ и накопление изолимонной кислоты. Последняя, как известно, повышает активность другого фермента – ацетил-КоА-карбоксилазы, которая в свою очередь катализирует I стадию превращения ацетил-КоА в жирную кислоту. Благодаря этим обстоятельствам клетка переводит образовавшуюся при гликолизе молекулу ацетил-КоА с энергетического пути на путь синтеза липидов и их отложения в депо. В то же время при восстановлении скорости утилизации АТФ, что обычно наблюдается при синтезе жирных кислот, соответствующее повышение уровня АМФ способствует снижению концентрации лимонной кислоты и соответственно торможению синтеза липидов.
Перечисленными примерами абсолютно не исчерпывается все многообразие взаимопревращений органических веществ, которые постоянно совершаются в живых организмах. Здесь приведены лишь главные, магистральные каналы и пути превращения общих классов веществ и указаны ключевые субстраты и ферментные системы, обеспечивающие постоянство химических компонентов и тканей и динамичность живых структур.
Таким образом, скорость распада одних питательных веществ и биосинтеза других прежде всего определяется физиологическим состоянием и потребностями организма в энергии и метаболитах. Благодаря динамичности и координации метаболической активности обеспечивается макро- и микроскопическое постоянство всех форм живого. Выяснение фундаментальных проблем структуры и функций отдельных биомолекул может служить основой для раскрытия как молекулярных механизмов химических процессов, лежащих в основе состава и функций отдельных клеток и целостного организма, так и процессов, обеспечивающих биологическую индивидуальность живых организмов. Любые нарушения этого динамического статуса организма сопровождаются развитием патологии, тяжесть и продолжительность которой будут определяться степенью повреждения структуры и функций отдельных молекулярных и надмолекулярных компонентов клеток.


