Амины
АМИНЫ [от ам (миак)], производные NH3, атомы Н в к-рых замещены на орг. остатки R. В зависимости от числа R амины делят на первичные RNH2, вторичные RR'NH и третичные RR'R"N; R,R',R" м.б. одинаковыми или разными. Соотв.—NH2 наз. первичной аминогруппой,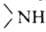 -вторичной и
-вторичной и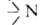 -третичной. По числу аминогрупп в молекуле различают моно-, ди-, три- и полиамины.
-третичной. По числу аминогрупп в молекуле различают моно-, ди-, три- и полиамины. К последним относится, напр., тетраэтиленпентамин H2N(CH2CH2NH)3CH2CH2NH2. Известны также циклич. амины, напр. пиперидин, хинуклидин.
Названия аминов образуют от названий орг. остатков, связанных с атомом N, напр. CH3NH2-метиламин, СН3NHС3Н7 - метилпропиламин, (С2Н5)3N - триэтиламин. Используются также названия, образованные прибавлением приставки "амино", "диамино" и т.д. к обозначению родового углеводорода, например соединение типа С2Н5СН(NН2)СН2СН3 - 3-аминопентан. Многие ароматич. Амины имеют тривиальные названия, напр. C6H5NH2 - анилин, СН3С6Н4NН2 - толуидины и СН3ОС6Н4NН2 - анизидины (соотв. от "толуол" и от "анизол"). Высшие алифатич. амины нормального строения иногда наз. по наименованиям радикалов жирных к-т, из к-рых амины были синтезированы, напр. стеариламин, трилауриламин.
В ИК-спектрах характерные валентные колебания связей NH в р-ре наблюдаются для первичных алкиламинов в областях 3380-3400 см-1 и 3320-3340 см-1; для первичных ароматич. аминов - две полосы поглощения в области 3500-3300 см-1 (обусловлены симметричными и несимметричными валентными колебаниями связей N—Н); для алифатич. и ароматич. вторичных амиов-одна полоса соотв. в области 3360-3310 см-1 и в области 3500-3300 см-1; третичные амины в этой области не поглощают. В спектрах ЯМР хим. сдвиг протона аминогруппы составляет 1-5 м.д. Алифатич. амины в УФ и видимой областях не поглощают, ароматич. амины в УФ-спектрах имеют две полосы поглощения, обусловленные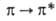 -переходами.
-переходами.
Алкиламины-сильные основания, ариламины менее ос-новны. При взаимод. с минеральными к-тами амины образуют соли, в большинстве случаев р-римые в воде: RNH2 + НС1 -> [R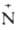 Н3]Сl-. При реакции, напр., первичных аминов с алкилгалогенидами образуются смеси аминов различной степени алкилирования, а также четвертичные соли аммония.
Н3]Сl-. При реакции, напр., первичных аминов с алкилгалогенидами образуются смеси аминов различной степени алкилирования, а также четвертичные соли аммония.
При нагр. с карбоновыми к-тами, их ангидридами, хлор-ангидридами или сложными эфирами первичные и вторичные амины ацилируются с образованием N-замещенных амидов, напр.: RNH2 + СН3СООН -> RNHCOCH3 + Н2О. Ангидриды реагируют в мягких условиях, еще легче - хлорангидриды, ацилирование к-рыми проводят в присут. основания, связывающего образующийся в р-ции НС1. При поликонденсации диаминов с дикарбоновыми к-тами, их эфирами или хлорангидридами образуются полиамиды. Ацилированные амины обладают слабыми основными св-вами.
Под действием HNO2 алифатич. первичные амины превращаются в спирты с выделением N2 и Н2О, вторичные - в N-нитрозамины R2NNO. Третичные амины при обычной т-ре с HNO2 не реагируют. Р-ция с HNO2 применяется для идентификации алифатич. аминов. При взаимод. первичных ароматич. аминов с HNO2 в кислой среде образуются соли диазония: ArNH2 + HNO2 + НС1 -> Аr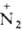 Сl- + 2H2O. В тех же условиях вторичные ароматич. амины превращаются в N-нитрозамины, третичные - в пара-нитрозопроизводные. Первичные алициклич. амины с HNO2 образуют спирты, что часто сопровождается сужением или расширением цикла (см. Демьянова перегруппировка).
Сl- + 2H2O. В тех же условиях вторичные ароматич. амины превращаются в N-нитрозамины, третичные - в пара-нитрозопроизводные. Первичные алициклич. амины с HNO2 образуют спирты, что часто сопровождается сужением или расширением цикла (см. Демьянова перегруппировка).
Алифатич. первичные и вторичные амины взаимод. с С12 или Вr2, образуя N-галогензамещенные. Первичные амины с фосгеном СОС12 образуют изоцианаты RNCO или дизамещенные мочевины (RNH)2CO, вторичные амины - тетразамещенные мочевины R2NCONR2. Первичные амины легко взаимод. с альдегидами, давая азометины (основания Шиффа), напр.: 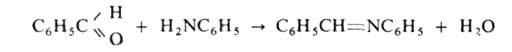
При взаимодействии первичных и вторичных аминов с этиленхлоргидрином образуются гидроксиэтильные производные, например: C6H5NH2+ С1СН2СН2ОН -> C6H5NHCH2CH2OH + НCl. Чаще для синтеза этих же соед. применяют этиленоксид, леско реагирующий с аминами в присут. небольших кол-в Н2О:
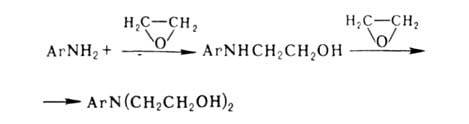
Поскольку скорости алкилирования на первой и второй стадиях одинаковы, для получения моноалкильного производного этиленоксид берут в кол-ве, значительно меньшем рассчитанного.
Цианэтильные производные первичных и вторичных аминов получают р-цией их с акрилонитрилом в присут. к-ты или щелочи: ArNH2 + CH2=CHCN -> ArNHCH2CH2CN. Первичные и вторичные алифатич. амины при взаимод. с CS2 образуют соли алкилдитиокарбаматов:
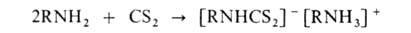
При нагр. первичных ароматич. аминов с CS2 в присут. щелочи образуются диарилтиомочевины, производные к-рых -важнейшие ускорители вулканизации:
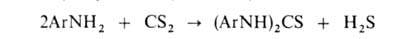
Гидрохлориды третичных аминов при нагр. с разб. к-тами дезалкилируются: (СН3)3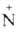 НСl -> (CH3)2NH + СН3С1.
НСl -> (CH3)2NH + СН3С1.
Под действием сильных окислителей, напр. КМnО4, первичные алифатич. амины превращаются в смесь в-в, в к-рой преобладают альдегиды, первичные ароматич. амины - в хиноны и их производные, вторичные алифатич. и ароматич. амины - в тетразамещенные гидразины. При окислении третичных аминов действием Н2О2 или надкислот образуются N-оксиды аминов:
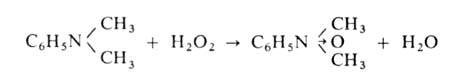
При замещении в ядро в ряду ароматич. аминов аминогруппа ориентирует электроф. замещение в орто- и пара-положения, а в сильно кислых средах вследствие протонирования атома N - и в мета-положение. Нитрование первичных ароматич. аминов осложняется их окислением, поэтому аминогруппу предварительно ацилируют.
Осн. пром. методы синтеза аминов:
1. Взаимод. спиртов с NH3 (аммонолиз спиртов) в присут. катализаторов дегидратации (напр., А12О3, SiO2, ThO2, алюмосиликатов, фосфатов металлов) при 300-500°С и 1-20 МПа. При этом образуются смеси первичных, вторичных и третичных аминов: ROH + NH3 -> RNH2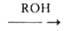 R2NH
R2NH RaN; одновременно происходит диспропорционирование аминов: 2RNH2 -> R2NH + + NH3, R2NH + RNH2 -> R3N + NH3, 2R2NH -> R3N + RNH2. Этот метод применяется для произ-ва низших алифатич. аминов, и прежде всего метил- и этиламинов. Синтез сопровождается образованием значит. кол-в побочных продуктов - олефинов.
RaN; одновременно происходит диспропорционирование аминов: 2RNH2 -> R2NH + + NH3, R2NH + RNH2 -> R3N + NH3, 2R2NH -> R3N + RNH2. Этот метод применяется для произ-ва низших алифатич. аминов, и прежде всего метил- и этиламинов. Синтез сопровождается образованием значит. кол-в побочных продуктов - олефинов.
При использовании вместо NH3 первичных или вторичных аминов получаются вторичные и (или) третичные амины. Этот метод (аминолиз) распространен для произ-ва N-алкил- и N,N-диалкиланилинов. Разработан аналогичный способ получения анилина взаимод. фенола с NH3. Очень легко реагируют с NH3 нафтолы, образуя нафтиламины (см. Бухерера реакции).
2. Восстановит. аминирование алифатич. и циклоалифатич. спиртов в присут. Н2 на катализаторах гидрирования-дегидрирования (N1, Со, Си, промотированное Fe). Процесс осуществляют при 150-250°С и 0,1-5 МПа: 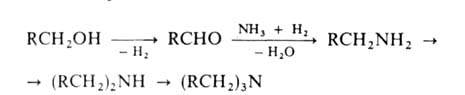
Вместо спиртов можно использовать альдегиды или кетоны; при этом образуется смесь первичных и вторичных аминов.
3. Каталитич. гидрирование нитрилов (кат.-Ni или Со) при 100-130 °С и 0,1-10 МПа. С хорошими выходами получаются первичные амины с примесью вторичных: 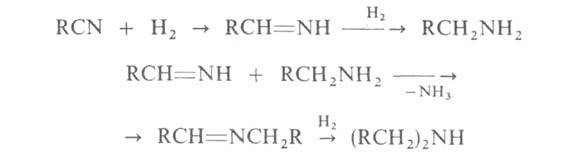
Этот метод применяется гл. обр. для произ-ва высших первичных и вторичных алифатич. аминов нормального строения.
4. Восстановление нитросоединений. Применяется гл. обр. для получения первичных ароматич. аминов: ArNO2 + 3Н2 -> ArNH2 + 2Н2О. Наиб. распространено ката-литич. восстановление водородом (кат.-Ni, Pt или Pd) в жидкой или паровой фазе, однако еще достаточно широко в качестве восстановителей используются металлы (Fe или Zn) и сульфиды щелочных металлов (см., напр., Зинина реакция, Вешана реакции).
5. Р-ция амидов алифатич. и ароматич. карбоновых к-т со щелочными р-рами С12, Вr2 или I2 с образованием первичных аминов. При этом углеродная цепь укорачивается на один атом (Гофмана реакции).
6. Р-ции с участием алкил- и арилгалогенидов. Конденсацией фталимида К с алкилгалогенидами с послед. гидролизом (см. Габриеля реакция)получают чистые первичные алифатические амины: 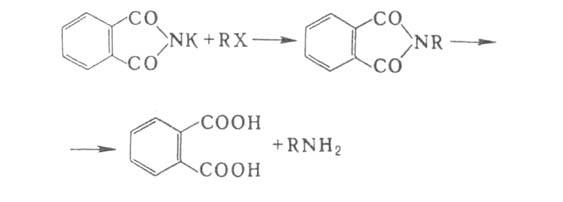
Арилгалогениды реагируют с NH3 и аминами с трудом, поэтому в пром-сти используют соед., в к-рых атом галогена активирован сильными электроноакцепторными заместителями, чаще всего нитро- или сульфогруппами. Таким способом получают разл. нитроанилины и производные дифениламина:
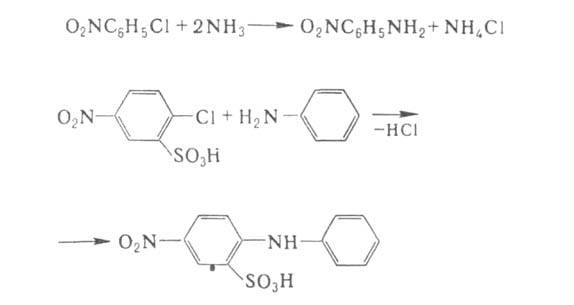
Аммонолиз и аминолиз арилгалогенидов с неактивированным галогеном требует применения соед. Си в качестве катализаторов.
7. Нитрозирование N,N-диалкиланилинов с послед. гидролизом (получение чистых вторичных алифатич. аминов):
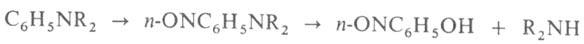
В лаборатории амины синтезируют, напр., р-циями Валлаха, Делепина, Курциуса, Лейкарта, Лоссена, Манниха.
Специфич. р-ции обнаружения аминов: первичные амины при нагр. с СНС13 в присут. щелочи превращаются в изонитрилы, обладающие очень сильным неприятным запахом: RNH2 + СНС13 -> RNC + ЗНС1; при обработке вторичных аминов HNO2, послед. сплавлении полученного осадка с фенолом и подкислении конц. H2SO4 появляется зеленое окрашивание. Для идентификации первичных и вторичных аминов используют их ацилирование в амиды. Для количеств. определения аминов применяют методы Кьельдаля и Ван Слайка (для первичных алифатич. аминов), бромометрич. метод, титрование р-рами к-т в водной и неводной средах, газожидкостную хроматографию. Первичные ароматич. амины определяют также фотометрически после образования соответствующих азосоединений или оснований Шиффа.
Амины - промежут. продукты в произ-ве красителей, пестицидов, полимеров (в т.ч. полиамидов и полиуретанов), ингибиторов коррозии, ПАВ, флотореагентов, абсорбентов, лек. ср-в (напр., сульфамидных препаратов), ускорителей вулканизации, антиоксидантов и др.
Алифатич. амины поражают нервную систему, вызывают нарушения проницаемости стенок кровеносных сосудов и клеточных мембран, ф-ций печени и развитие дистрофии. Ароматич. амины вызывают образование метгемоглобина, угнетающего центр. нервную систему. Нек-рые ароматич. А-канцерогены, вызывающие рак мочевого пузыря у человека (напр., р-нафтиламин, бензидин, 4-аминобифенил).
Литература
Терней А., Современная органическая химия, пер. с англ., т. 2, М., 1981; Общая органическая химия, пер. с англ., т. 3, М., 1982, с. 11-91, 168-228; Ullmanns Encyklopadie, 4 Aufl., Bd 7, Weinheim, 1974: Kirk-Othmer encyclopedia, 3 ed., v. 2, N.Y.-[a.o.], 1978, p. 272-376. Б.В. Салол.
