Органические перекисные соединения. Гидроперекиси алкилов
Подобно тому, как от воды можно произвести классы спиртов и простых эфиров, так от перекиси водорода НО—ОН можно произвести классы органических гидроперекисей, содержащих группировку —О—О—Н, и органических перекисей, в которых имеется группировка —О—О—. Эти группировки могут быть связаны с алкилами (гидроперекиси и перекиси алкилов), с оксиалкилами (перекисные соединения, получаемые из альдегидов и кетонов, стр. 253), с α-алкоксиалкилами (например, гидроперекиси простых эфиров, стр. 224), с ацилами (надкислоты и диацилперекиси, стр. 307) и т. п.
Гидроперекиси алкилов
Гидроперекиси жирных радикалов — маслянистые жидкости с неприятным запахом, напоминающим запах озона, обжигающие кожу, подобно высокопроцентной перекиси водорода. Низшие члены этого ряда растворимы в воде, высшие — обладают ограниченной растворимостью.
Гидроперекиси алкилов могут быть получены, например, действием на перекись водорода диалкилсульфатов:
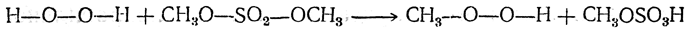
При избытке диалкилсульфата реакция может пойти дальше — с образованием перекисей алкилов.
Гидроперекись метила СН3—О—О—Н перегоняется при осторожном нагревании в вакууме (65 мм рт. ст.) при 38—40° С.
Гидроперекиси первичных радикалов малоустойчивы, и работа с ними требует особой осторожности, так как они при перегреве или соприкосновении с пламенем сильно взрывают. Более устойчивы гидроперекиси вторичных радикалов, например гидроперекись изопропила (СН3)2СН—О—О—Н — жидкость, при атмосферном давлении перегоняющаяся при 107—109° С.
Еще прочнее гидроперекиси третичных радикалов, представителем которых является гидроперекись трет-бутила
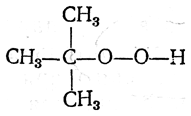
Она представляет собой жидкость, застывающую при —13,5° С, перегоняющуюся в вакууме (18 мм рт. ст.) при 38—38,5° С; 60%-ные растворы гидроперекиси трет-бутила (в триметилкарбиноле) безопасны в обращении и применяются в технике.
Гидроперекиси алкилов быстро выделяют иод из подкисленных растворов иодистого калия
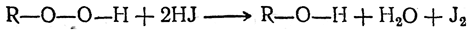
на чем основано их качественное и количественное определение. Гидроперекиси алкилов обладают слабыми кислотными свойствами и дают с едкими щелочами соответствующие металлические производные, например NaOOR, Ba(OOR)2, которые иногда удается выделить в кристаллическом виде. Углекислота тотчас же вытесняет из этих «солей» свободные гидроперекиси.
При термическом разложении гидроперекисей сначала, по-видимому, образуются свободные радикалы
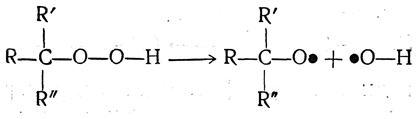
которые могут являться инициаторами некоторых цепных реакций, например реакций полимеризации винильных соединений или диенов. В качестве такого инициатора в технике применяется гидроперекись трет-бутила.
Установлено, что во многих (если не в большинстве) случаях гидроперекиси алкилов являются первичными продуктами окисления кислородом органических веществ.
Более шестидесяти лет назад (1897) А. Н. Бах высказал впервые мысль о том, что окисляющая молекула кислорода не разрывается на отдельные атомы, а присоединяется как одно целое к окисляемому веществу. Сейчас вопрос о механизме окисления углеродистых соединений, по-видимому, близок к выяснению. Оказывается, что окислительные процессы являются цепными реакциями, чувствительными к малейшим посторонним примесям, и, по-видимому, протекают таким образом:
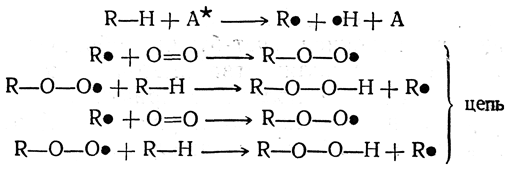
Здесь А* — возбужденная молекула инициатора цепной реакции.
Все конечные продукты окисления являются продуктами дальнейших превращений первичных гидроперекисей.


