Гомеополярная (ковалентная) связь
При соединении друг с другом одинаковых атомов или атомов, обладающих близким по своему значению сродством к электрону, между ними образуется гомеополярная, или ковалентная, связь. Последний термин в настоящее время употребляется чаще.
Ковалентная связь между атомами в химических соединениях
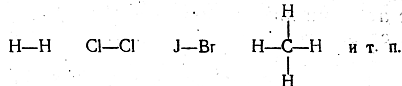
осуществляется общей парой электронов (электроны обычно . изображаются точками):
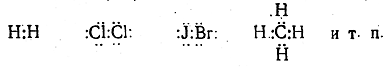
Вопрос об отличии ковалентных связей от ионных можно решить, пользуясь несколькими критериями. Важным критерием является полярность связи, т. е. наличие постоянного ди-польного момента.
Дипольный момент гомеополярных связей в огромном боль шинстве случаев не превышает 1,0 D а для гомеополярных связей между одинаковыми атомами он близок или равен нулю. Ионная связь, напротив, обладает очень большой полярностью, так как результирующие положительный и отрицательный заряды сосредоточены в центрах ионов и находятся на сравнительно большом расстоянии друг от друга. Дипольный момент ионной связи равен примерно 9—12 D так как заряд электрона равен 4,8 · 10-10 электростатических единиц, а длина ионной связи составляет 2—3 A. Опытные данные соответствуют этой величине (для КСl — 8 D для КВr — 9,07 D для CsJ — 10,2 D).
Одним из наиболее характерных и важных свойств кова-лентной связи, в отличие от ионной связи, является ее неизменная пространственная направленность. Так, в ковалентно построенных симметричных молекулах СН4, ССl4, С(СН3)4 угол между направлениями связей равен 109°28'. Ковалентные связи кислорода, серы, азота, фосфора, мышьяка и некоторых других элементов также имеют определенное направление в пространстве.
Гетерополярные соединения склонны образовывать ионные кристаллические решетки, строение которых определяется размерами ионов, величиной сил отталкивания и другими факторами. Характерной особенностью таких решеток является то, что связи иона с каждым из ближайших соседей одинаково прочны. Гомеополярные соединения дают в твердом состоянии молекулярные кристаллические решетки, построенные из отдельных молекул, удерживаемых в кристалле небольшими ван-дер-ваальсовыми силами. Наличие в узлах решетки молекул как дискретных единиц объясняется присущим ковалентным связям свойством насыщаемости, т. е. тем, что ковалентно связанные атомы одной молекулы уже не могут дополнительно связываться с атомами другой молекулы.
Отличия в строении ионных и молекулярных решеток внешне проявляются в различных физических свойствах твердых ионных и твердых ковалентных соединений. Так, энергии сублимации ионных соединений (переход из твердого состояния в газообразное) обычно велики, например 50—60 ккал/моль для солей типа NaCl. Энергия сублимации кристаллических ковалентных соединений меньше (примерно 10 ккал/моль). Ионные соединения имеют высокие точки плавления, в то время как несложные ковалентные соединения (Н2, Cl2, CH4, SiH4, CF4, SiF4) при обычных условиях — газообразные вещества. Отличия ионных соединений от ковалентных в известной мере проявляются также при растворении их в воде. Водные растворы ионных соединений способны проводить электрический ток вследствие наличия в таких растворах свободных (точнее — гидратирован-ных) ионов. Ковалентные соединения зачастую вовсе нерастворимы в воде. Если же они растворяются в воде, то их растворы не содержат ионов, а потому не проводят электрического тока. Следует, впрочем, применять этот критерий с осторожностью. Так, например, молекула хлористого водорода, построенная ко-валентно, распадается в воде на ионы вследствие громадного сродства воды к протону (180 ккал/моль); здесь происходит уже не простое растворение, а химическая реакция:
НСl + Н2О ------> Н3О+ + Сl-
Критерием ковалентности или ионности связи может также служить ее энергия.
Если принять, что энергия ковалентной связи А—В равна полусумме энергии связей А—А и В—В (формула Л. Полинга)
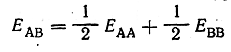
то для ковалентно построенных соединений удается получить хорошее совпадение вычисленной энергии связи с экспериментальной. Так, например, для молекул BrCl, JCl, JBr, NaK вычисленные энергии связи (в ккал) составляют 51, 46, 40 и 14,5, а определенные экспериментальным путем—соответственно 52, 49, 42 и 14,5. Резкое же расхождение величины вычисленной таким образом энергии с найденной опытным путем указывает на то, что мы имеем дело не с ковалентной, а с ионной связью. Так, для молекулы NaCl вычисленная энергия составляет 37 ккал, а найденная экспериментально 98 ккал.
Как и во всякой классификации вообще, при делении химических связей на ионные и ковалентные оказывается, что имеется ряд случаев промежуточных форм связи между ионной и ковалентной. Поэтому целесообразно подразделить ковалентные связи на полярные (с дипольным моментом μ = 1—2 D) и гомео-полярные (μ ≈ 0). Однако качественные отличия электронного строения типично ионных и типично ковалентных связей, а также некоторые типичные отличия в свойствах ионно и ковалентно построенных соединений являются подтверждением правильности и законности такой классификации.
Предыдущая страница | Сдедующая страница | Содержание