КАРБАНИОНЫ, орг. анионы с четным числом электронов, отрицат. заряд в к-рых (по крайней мере, формально) сосредоточен на атоме углерода. Примеры карбанионов СН2=СН—СН2-, РhСН2-, -СН(СООС2Н5)2. Карбанионный центр в отсутствие сопряженных с ним заместителей имеет пирамидальную конфигурацию, претерпевающую быструю инверсию; при наличии p-сопряженных заместителей плоскую конфигурацию. Обычно карбанионы образуют ионнопостроенные соед., напр. Ph3C-Na+. Генерируют карбанионы отрывом протона от орг. соед. RH (т. наз. СH-кислоты) под действием сильных оснований:
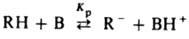 , где Кр - константа равновесия, В -
основание. При отрыве двух, трех или большего числа протонов образуются соотв. ди-, три- или полианионы. Карбанионы могут также образовываться в качестве промежут продуктов при электроф. замещении. Стабильность карбанионов и, следовательно, легкость их получения растет при наличии в RH электроноакцепторных групп (вследствие делокализации заряда по системе сопряженных или кратных связей), а также в р-ре из-за сольватации. Количеств. характеристикой стабильности карбанионов (или кислотности СН-кислоты) обычно служит константа равновесия Кр или параметр рКа = — lgKp. Значения рКа определены для мн. орг соед. в протонодонорных (вода и водно-спиртовые смеси) и в апротонных (ТГФ, 1,2-диметоксиэтан, циклогексиламин, ДМСО и др.) р-рителях, а также в газовой фазе методом ионного циклотронного резонанса. Концентрация своб. карбанионов в
р-ре обычно мала. Они существуют в осн. в виде контактных и сольватно-разделенных ионных пар.
Относит. содержание ионных частиц разл. типа зависит от строения карбаниона, размера катиона, природы среды и т-ры. Все эти частицы имеют, как правило, разл. спектральные характеристики и отличаются по реакц. способности. Напр., нуклеоф. замещение и присоединение с участием своб. карбанионов происходит в 10-104 раз быстрее, чем с участием ионных пар.
Карбанионы, особенно образующиеся из СН-кислот с рКа > 10, химически очень активны. Они подвергаются внутримол. превращ., приводящим к более устойчивым структурам. В карбанионах аллильного и пропаргильного типов обычно происходит миграция кратных связей. Карбанионы в перегруппировках Стивенса и бензильной, р-циях Соммле, Виттига претерпевают 1,2-миграцию; перегруппировка Фаворского протекает со стадией 1,3-элиминирования. наиб. важны в орг. синтезе р-ции карбанионов, приводящие к образованию связей С—С: нуклеоф. замещение (напр., р-ция Вюрца) и присоединение по карбонильной группе (напр., конденсации Клайзена, альдольная, р-ции Манниха, Кнёвенагеля, Перкина) и по активир. двойной связи (напр., присоединение по Михаэлю и анионная полимеризация). Широкое распространение получили синтезы на основе карбанионов, проводимые в условиях межфазного катализа.
, где Кр - константа равновесия, В -
основание. При отрыве двух, трех или большего числа протонов образуются соотв. ди-, три- или полианионы. Карбанионы могут также образовываться в качестве промежут продуктов при электроф. замещении. Стабильность карбанионов и, следовательно, легкость их получения растет при наличии в RH электроноакцепторных групп (вследствие делокализации заряда по системе сопряженных или кратных связей), а также в р-ре из-за сольватации. Количеств. характеристикой стабильности карбанионов (или кислотности СН-кислоты) обычно служит константа равновесия Кр или параметр рКа = — lgKp. Значения рКа определены для мн. орг соед. в протонодонорных (вода и водно-спиртовые смеси) и в апротонных (ТГФ, 1,2-диметоксиэтан, циклогексиламин, ДМСО и др.) р-рителях, а также в газовой фазе методом ионного циклотронного резонанса. Концентрация своб. карбанионов в
р-ре обычно мала. Они существуют в осн. в виде контактных и сольватно-разделенных ионных пар.
Относит. содержание ионных частиц разл. типа зависит от строения карбаниона, размера катиона, природы среды и т-ры. Все эти частицы имеют, как правило, разл. спектральные характеристики и отличаются по реакц. способности. Напр., нуклеоф. замещение и присоединение с участием своб. карбанионов происходит в 10-104 раз быстрее, чем с участием ионных пар.
Карбанионы, особенно образующиеся из СН-кислот с рКа > 10, химически очень активны. Они подвергаются внутримол. превращ., приводящим к более устойчивым структурам. В карбанионах аллильного и пропаргильного типов обычно происходит миграция кратных связей. Карбанионы в перегруппировках Стивенса и бензильной, р-циях Соммле, Виттига претерпевают 1,2-миграцию; перегруппировка Фаворского протекает со стадией 1,3-элиминирования. наиб. важны в орг. синтезе р-ции карбанионов, приводящие к образованию связей С—С: нуклеоф. замещение (напр., р-ция Вюрца) и присоединение по карбонильной группе (напр., конденсации Клайзена, альдольная, р-ции Манниха, Кнёвенагеля, Перкина) и по активир. двойной связи (напр., присоединение по Михаэлю и анионная полимеризация). Широкое распространение получили синтезы на основе карбанионов, проводимые в условиях межфазного катализа.
===
Исп. литература для статьи «КАРБАНИОНЫ»: Крам Д., Основы химии карбанионов, пер. с англ., М., 1967; Реутов О. А., Белецкая И. П., Бутин К. П., СН-Кислоты, М., 1980; Ионы и ионные пары в органических реакциях, пер. с англ., М., 1975; Соловьянов А. А., Белецкая И. П., "Успехи химии", 1978, т. 47, в. 5, с. 819-46; Общая органическая химия, пер. с англ., т. 1, М., 1981. с. 545-68. А. А Соловьянов.
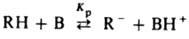 , где Кр - константа равновесия, В -
основание. При отрыве двух, трех или большего числа протонов образуются соотв. ди-, три- или полианионы. Карбанионы могут также образовываться в качестве промежут продуктов при электроф. замещении. Стабильность карбанионов и, следовательно, легкость их получения растет при наличии в RH электроноакцепторных групп (вследствие делокализации заряда по системе сопряженных или кратных связей), а также в р-ре из-за сольватации. Количеств. характеристикой стабильности карбанионов (или кислотности СН-кислоты) обычно служит константа равновесия Кр или параметр рКа = — lgKp. Значения рКа определены для мн. орг соед. в протонодонорных (вода и водно-спиртовые смеси) и в апротонных (ТГФ, 1,2-диметоксиэтан, циклогексиламин, ДМСО и др.) р-рителях, а также в газовой фазе методом ионного циклотронного резонанса. Концентрация своб. карбанионов в
р-ре обычно мала. Они существуют в осн. в виде контактных и сольватно-разделенных ионных пар.
Относит. содержание ионных частиц разл. типа зависит от строения карбаниона, размера катиона, природы среды и т-ры. Все эти частицы имеют, как правило, разл. спектральные характеристики и отличаются по реакц. способности. Напр., нуклеоф. замещение и присоединение с участием своб. карбанионов происходит в 10-104 раз быстрее, чем с участием ионных пар.
Карбанионы, особенно образующиеся из СН-кислот с рКа > 10, химически очень активны. Они подвергаются внутримол. превращ., приводящим к более устойчивым структурам. В карбанионах аллильного и пропаргильного типов обычно происходит миграция кратных связей. Карбанионы в перегруппировках Стивенса и бензильной, р-циях Соммле, Виттига претерпевают 1,2-миграцию; перегруппировка Фаворского протекает со стадией 1,3-элиминирования. наиб. важны в орг. синтезе р-ции карбанионов, приводящие к образованию связей С—С: нуклеоф. замещение (напр., р-ция Вюрца) и присоединение по карбонильной группе (напр., конденсации Клайзена, альдольная, р-ции Манниха, Кнёвенагеля, Перкина) и по активир. двойной связи (напр., присоединение по Михаэлю и анионная полимеризация). Широкое распространение получили синтезы на основе карбанионов, проводимые в условиях межфазного катализа.
, где Кр - константа равновесия, В -
основание. При отрыве двух, трех или большего числа протонов образуются соотв. ди-, три- или полианионы. Карбанионы могут также образовываться в качестве промежут продуктов при электроф. замещении. Стабильность карбанионов и, следовательно, легкость их получения растет при наличии в RH электроноакцепторных групп (вследствие делокализации заряда по системе сопряженных или кратных связей), а также в р-ре из-за сольватации. Количеств. характеристикой стабильности карбанионов (или кислотности СН-кислоты) обычно служит константа равновесия Кр или параметр рКа = — lgKp. Значения рКа определены для мн. орг соед. в протонодонорных (вода и водно-спиртовые смеси) и в апротонных (ТГФ, 1,2-диметоксиэтан, циклогексиламин, ДМСО и др.) р-рителях, а также в газовой фазе методом ионного циклотронного резонанса. Концентрация своб. карбанионов в
р-ре обычно мала. Они существуют в осн. в виде контактных и сольватно-разделенных ионных пар.
Относит. содержание ионных частиц разл. типа зависит от строения карбаниона, размера катиона, природы среды и т-ры. Все эти частицы имеют, как правило, разл. спектральные характеристики и отличаются по реакц. способности. Напр., нуклеоф. замещение и присоединение с участием своб. карбанионов происходит в 10-104 раз быстрее, чем с участием ионных пар.
Карбанионы, особенно образующиеся из СН-кислот с рКа > 10, химически очень активны. Они подвергаются внутримол. превращ., приводящим к более устойчивым структурам. В карбанионах аллильного и пропаргильного типов обычно происходит миграция кратных связей. Карбанионы в перегруппировках Стивенса и бензильной, р-циях Соммле, Виттига претерпевают 1,2-миграцию; перегруппировка Фаворского протекает со стадией 1,3-элиминирования. наиб. важны в орг. синтезе р-ции карбанионов, приводящие к образованию связей С—С: нуклеоф. замещение (напр., р-ция Вюрца) и присоединение по карбонильной группе (напр., конденсации Клайзена, альдольная, р-ции Манниха, Кнёвенагеля, Перкина) и по активир. двойной связи (напр., присоединение по Михаэлю и анионная полимеризация). Широкое распространение получили синтезы на основе карбанионов, проводимые в условиях межфазного катализа.
===
Исп. литература для статьи «КАРБАНИОНЫ»: Крам Д., Основы химии карбанионов, пер. с англ., М., 1967; Реутов О. А., Белецкая И. П., Бутин К. П., СН-Кислоты, М., 1980; Ионы и ионные пары в органических реакциях, пер. с англ., М., 1975; Соловьянов А. А., Белецкая И. П., "Успехи химии", 1978, т. 47, в. 5, с. 819-46; Общая органическая химия, пер. с англ., т. 1, М., 1981. с. 545-68. А. А Соловьянов.
Страница «КАРБАНИОНЫ» подготовлена по материалам химической энциклопедии.
Активные темы форума