§ 2. Подгруппа меди
Содержание меди в земной коре составляет 0,003%, серебра – 2 10–6%, а золота – 5 ·10–8%.
Медь и серебро встречаются главным образом в виде сернистых соединений. Из минералов меди наиболее важны медный колчедан (CuFeS2 ) и медный блеск (Cu2 S). Гораздо меньшее промышленное значение имеют кислородсодержащие минералы–куприт (Cu2 О), малахит [(CuОН)2 СО3 ] и др.
Сернистое серебро как отдельный минерал (аргентит– Ag2 S) встречается сравнительно редко. Напротив, весьма обычно нахождение Ag2 S в виде примеси к сернистым рудам Pb, Zn и Cu. Обычной формой нахождения в природе золота является самородное состояние: в виде вкраплений в горных породах, россыпей золотого песка и отдельных самородков. Одной из наиболее богатых месторождениями золота стран является СССР.
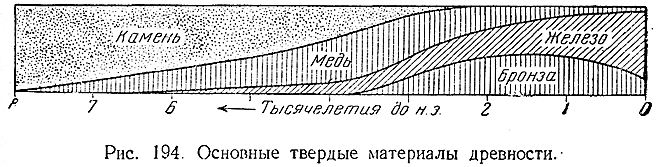
Подобно золоту, иногда встречаются в самородном состоянии также серебро и медь. Вероятно, именно поэтому все три элемента и были известны человечеству еще в самой глубокой древности. Из них медь являлась, по–видимому, первым металлом, широко использованным для изготовления орудий труда (рис. 194).
1) В древности и еще в прошлом столетии добыча золота производилась из россыпей, образовавшихся путем выветривания и размыва природными водами содержащих Au горных пород. В настоящее время золото добывается непосредственно из таких пород, которые подвергают дроблению и размалыванию.
При среднем содержании золота эксплуатируемых ныне месторождений всего лишь в 0,001% отделение его от пустой породы старым, основанным на различии в плотности способом отмывки водой становится неэкономичным. Вместо него пользуются цианидным методом, который позволяет практически полностью выделять золото даже из самых бедных пород.
Для извлечения Au размолотую золотосодержащую породу обрабатывают при доступе воздуха очень разбавленным (0,03–0,2%) раствором NaCN. При этом золото по уравнению:
4Au + 8NaCN + 2H2 O + О2 = 4Na[Au(CN)2 ] + NaOH
переходит в раствор, из которого затем выделяется действием металлического цинка:
2Na[Au(CN)2 ] + Zn = Na2 [Zn(CN)4 ] + 2Au
Очистка полученного тем или иным путем золота от примесей («аффинаж») производится чаще всего обработкой его горячей концентрированной H2 SO4 или при помощи электролиза.
2) Большая часть добываемого в настоящее время серебра получается при переработке не собственно серебряных руд, а содержащих примеси Ag сернистых руд Pb, Zn и Cu. Очистка Ag производится чаще всего путем электролиза.
3) Выплавка меди из ее сернистых руд распадается на несколько стадий. Прежде всего руду обжигают на воздухе для удаления главной массы содержащейся в ней серы. Обожженную руду с добавкой флюсов затем переплавляют. При этом пустая порода ичасть железа переходят в шлак, a Cu2 S, FeS и небольшие количества других примесей сплавляются в «штейн» (который собирается на дне печи). Последний переводят в специальные конверторы, где медь освобождается от серы и железа путем продувания через расплавленную массу воздуха.
Выплавка меди из окисных руд несравненно проще, чем из сернистых, так как сводится к легко протекающему восстановлению углем. Именно таким путем и добывали, по–видимому, медь в древности. Выработка ее в Египте достигала значительных размеров уже за 3000 лет до н. э.
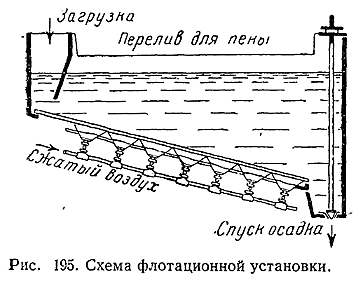
4) Так как содержание Cu в эксплуатируемых рудах обычно не превышает 2%, для рентабельной их переработки необходимо предварительное обогащение, т. е. повышение процентного содержания металла в руде за счет отделения его соединений от пустой породы. Это достигается применением метода флотации руд, основанного на различных адсорбционных свойствах поверхностей частиц сернистых металлов и окружающей их пустой породы силикатного типа.
Если в водный раствор какого–либо малополярного органического вещества поместить смесь порошков силиката и сернистого металла, то на поверхности первого будут адсорбироваться почти исключительно молекулы воды, на поверхности второго – малополярные молекулы растворенного органического вещества. С другой стороны, если через такой раствор пропускать пузырьки воздуха, то последние будут адсорбировать на своей поверхности также почти и ключительно малополярные молекулы.
Покрытые одинаковыми адсорбированными слоями частицы сернистых металлов и продуваемые через раствор пузырьки воздуха легко слипаются друг с другом. Напротив, частицы силикатов к пузырькам воздуха не прилипают. Если в воде, содержащей небольшую примесь малополярного органического вещества (например, соснового масла), взболтать порошок тонко измельченной медной руды и через всю систему продувать воздух (рис. 195), то частицы сернистой меди будут вместе с воздушными пузырьками подниматься вверх и перетекать через край сосуда в виде пены, а частицы силикатов осядут на дно, На этом и основан флотационный метод обогащения, при помощи которого ежегодно перерабатывается более 100 млн. т сернистых руд различных металлов.
В элементарном состоянии Cu, Ag и Au представляют собой металлы соответственно красного, белого и желтого цвета. Их важнейшие константы сопоставлены в приводимой ниже таблице, а характер изменения свойств по подгруппе виден из рис. 196.
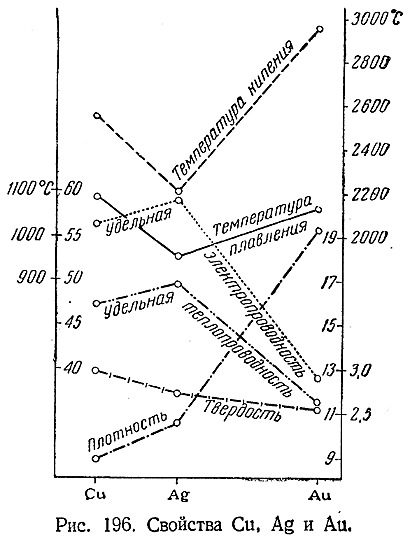
Все три металла характеризуются значительными удельными весами, довольно высокими температурами плавления и кипения и сравнительно малой твердостью. Тягучесть и ковкость меди и ее аналогов (особенно Au) исключительно велики. Из 1 г золота можно вытянуть проволоку длиной 3 км, а путем ковки или прокатки Au могут быть по лучены листочки («золотая фольга») толщиной до 0,0001 мм. Такие листочки в 500 раз тоньше человеческого волоса. Они имеют в отраженном свете желтый, а в проходящем – зеленый цвет. По своей электро– и теплопроводности элементы подгруппы меди также превосходят все остальные металлы.

Друг с другом и со многими другими металлами Сu, Ag и Аu легко образуют сплавы. В частности, все они сплавляются со ртутью (труднее остальных Cu). На легком образовании амальгамы Аu основан иногда применяемый метод извлечения золота из содержащих его горных пород.
5) Основными потребителями меди являются электротехника и металлургия. В. первой из них медь используется главным образом для изготовления электрических проводов, а во второй для выработки сплавов с другими металлами–– оловом (бронз), цинком (латуней) и т. д. Ежегодная мировая добыча меди составляет около 3 млн. т.
Серебро служит главным образом для выделки разменной монеты, домашней утвари и украшений. Соединения Ag находят применение преимущественно в фотографической промышленности. Ежегодная мировая выработка серебра составляет около 6000 г.
Золото является основой денежной системы большинства стран. Оно употребляется также для выделки различных предметов роскоши, золочения других металлов и т. п. Ежегодная мировая добыча золота составляет около 1000 г.
6) Для выделки украшений и предметов роскоши употребляются обычно сплавы Ag или Аu с медью, состав которых («пробу») выражают числом весовых частей драгоценного металла в 1000 частях сплава. В СССР сохранилось еще много изделий, помеченных прежним русским способом – числом золотников драгоценного металла в фунте (96 золотников) сплава. В этом выражении золотые изделия изготовлялись обычно 56, а серебряные – 84 пробы.
Химическая активность меди и ее аналогов невелика и по ряду Cu–Ag–Au быстро уменьшается. Золото и серебро на воздухе не изменяются, а медь постепенно покрывается плотной зеленовато–серой пленкой основных углекислых солей. С кислородом непосредственно соединяется только медь (при нагревании), с серой – уже не только Cu, но и Ag. С водородом, азотом и углеродом Cu, Ag и Au не реагируют даже при высоких температурах.
Значительно легче, чем с другими элементами, идет взаимодействие меди и ее аналогов со свободными галоидами. Сама медь легко соединяется с ними уже при обычной температуре, в случае серебра реакция протекает лишь медленно, а золото реагирует с сухими галоидами только при нагревании. Напротив, в водном растворе хлора («хлорной воде») золото растворяется легко. При этих условиях реакция взAuмодействия медленнее всего протекает у серебра ввиду покрытия его поверхности слоем труднорастворимого хлористого серебра.
В ряду напряжений все три элемента располагаются правее водорода, причем медь стоит почти рядом с ним, а золото – дальше всех остальных металлов. Поэтому в растворах таких кислот, как НСl, H2 SO4 и т. п., при отсутствии окислителей не растворяется даже медь. В кислотах, одновременно являющихся окислителями (НNОз и т. п.), медь и серебро растворяются легко, а золото лишь в том случае, когда окислительные свойства кислоты выражены особенно сильно. Лучшим растворителем для него является насыщенная хлором соляная кислота, взаимодействующая с золотом по уравнению:
2Au + ЗСl2 + 2НСl = 2Н[AuСl4 ]
Хорошо растворяет золото также царская водка (IX § 3). По отношению к сильным щелочам элементы подгруппы меди устойчивы.
В своих соединениях серебро главным образом одновалентно. Напротив, Cu и Au образуют по два довольно хорошо изученных ряда производных. Cu – одно– и двухвалентного, Au – одно– и трехвалентного элемента. Более устойчивыми и практически важными являются в большинстве случаев производные двухвалентной меди и трехвалентного золота. Все растворимые соединения Cu, Ag и Au ядовиты.
Наиболее характерной особенностью большинства соединений рассматриваемых элементов является легкость восстановления их до металлов. В соответствии с положением в ряду напряжений легче всего восстанавливается Au, труднее всего – Cu. Другой весьма резко выраженной чертой является их склонность к комплексообразованию.
7) Интересное применение находит получаемое восстановлением мелко раздробленное серебро в санитарной технике. Как показывает опыт, ион Ag+обладает исключительно сильно выраженными бактерицидными (убивающими бактерии) свойствами. Например, выдержанная некоторое время в серебряных сосудах вода может затем долго сохраняться без загнивания, так как она оказывается стерилизованной уже той ничтожной концентрацией иона Ag+, которая в ней. создается при соприкосновении с металлическим серебром.
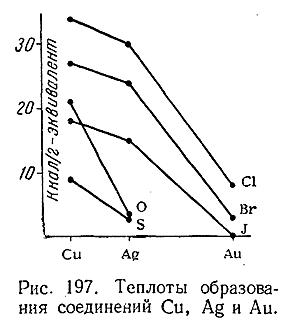
Теплоты образования соединений одновалентных Cu, Ag и Au сопоставлены на рис. 197. Как видно из последнего, при переходе от Cu к Au они во всех случаях уменьшаются.
Окислы типа Э2 О носят название закисей (Ag2 O иногда называют окисью серебра). Все они окрашены в характерные цвета: CuО –красный, Ag2 O –темно–бурый, Au2 О – серо–фиолетовый.
В воде окислы Э2 О почти нерастворимы и присоединяют ее с образованием гидратов закисей (ЭОН) лишь в очень малой степени. Гидраты эти являются основаниями средней силы. Так, важная Ag2 O отчетливо окрашивает лакмусовую бумажку в синий цвет.
Многие соли Cu+, Ag+и Au+ окраины даже при наличии в молекуле бесцветного аниона. Почти все производные Cu+ и Au+ практически нерастворимы в воде и во влажном состоянии неустойчивы.
Напротив, соединения Ag+находят разнообразное применение, хотя большинство солей Ag+труднорастворимо в воде, однако известны и хорошо растворимые. Последние показывают в растворе нейтральную реакцию на лакмус. Наиболее важно азотнокислое серебро (AgNO3 ), которое получают по реакции:
3Ag + 4HNO3 = 3AgNO3 + NO + 2H2 O
Эта хорошо растворимая в воде бесцветная соль служит обычным исходным продуктом для приготовления остальных соединений серебра. Из последних большое значение имеют почти нерастворимые в воде галоидные соли – белое AgCl, желтоватое AgBr к желтое AgJ, так как идущий под действием света распад их с выделением металлического Ag лежит в основе фотографического процесса. Подобно галоидным солям, постепенно распадается под действием света и большинство других соединений серебра. Поэтому их (а также их растворы) хранят обычно в банках из темного стекла.
С рядом молекул и ионов (NH3 , CN–, S2 O3 2– и т. д.) соли одновалентных Cu, Ag и Au образуют комплексные соединения. Так как последние большей частью хорошо растворимы, их образование влечет за собой растворение многих нерастворимых в воде исходных солей. Например, вследствие комплексообразования по схеме
AgCl + 2NH3 = [Ag(NH8 )2 ]Cl
нерастворимое в воде AgCl растворяется в NH4 OH. У производных Cu+ и Au+ комплексообразование часто сопровождается не только их растворением, но и повышением устойчивости.
8) Азотнокислое серебро широко используется при изготовлении зеркал и в медицине (часто в виде сплава 1 ч. AgNO3 и 2 ч. KNO3 под названием «ляпис»). Раствором AgNO3 в водном аммиаке иногда пользуются также для нанесения несмываемых при стирке меток на белье. Проявление и закрепление метки достигается путем немедленного проглаживания помеченного места горячим утюгом. Следует отметить, что раствор аммиачного комплекса серебра нельзя хранить (так как при стоянии из него выделяется весьма взрывчатый осадок).
9) Фотографические пластинки или пленки состоят в основном из слоя тонкой взвеси галогенида Ag (чаще всего – AgBr) в желатине, нанесенного на стекло или целлулоид. Обычная толщина такого слоя составляет около 20 мк.
Освещение пластинки или пленки ведет к распаду содержащегося в ней галогенида Ag, причем галоид химически связывается желатиной, а серебро образует мельчайшие зародышевые кристаллики. Последних на данном участке поверхности возникает тем больше, чем более сильному освещению этот участок подвергался. Таким образом, несмотря на внешнюю однородность находившейся под кратковременным действием света пластинки или пленки, на ней уже содержится «скрытое изображение» фотографируемого предмета.
Чтобы сделать его видимым, пластинку или пленку подвергают операции проявления, заключающейся в дальнейшем восстановлении галогенида серебра до свободного Ag химическим путем. В качестве проявителя пользуются обычно каким–либо органическим восстановителем. Существенно важно для процесса проявления то обстоятельство, что восстановление галоидного серебра быстрее всего протекает в соседстве с уже имеющимися зародышевыми кристалликами Ag. Обусловлено это, по–видимому, адсорбцией на них проявителя,одной стороны, и ролью зародышей в качестве центров кристаллизации для вновь выделяющегося металлического серебра–с другой.
Достигнув при помощи проявления достаточной четкости видимого изображения, пластинку или пленку фиксируют для того, чтобы уничтожить ее чувствительность к дальнейшему действию света. Фиксаж осуществляется путем извлечения из светочувствительного слоя оставшихся неразложенными галогенидов серебра. В качестве фиксирующего агента пользуются обычно раствором гипосульфита, легко растворяющим галогениды Ag за счет комплексообразования по схеме:
2Na2 S2 O3 + AgГ = Na3 [Ag(S2 O)2 ] + NaГ.
Получаемое путем проявления и фиксирования устойчивое на свету видимое изображение – негатив – является обратным истинному, так как темные места на нем отвечают светлым местам фотографируемого объекта, и обратно. Для получения истинного изображения негатив накладывают на другую пластинку, пленку или бумагу со светочувствительным слоем и подвергают действию света. Так как свет легче проходит через более светлые места негатива и труднее – через более темные, отношение между светом и тенью меняется при таком «печатании» снимков на обратное и становится отвечающим сфотографированному объекту. Отпечатанный снимок – позитив – подвергают затем проявлению и фиксированию (или только последнему, если светочувствительный слой был рассчитан на непосредственное получение видимого изображения).
10) Черный Ag2 S представляет собой наиболее труднорастворимую соль серебра и поэтому осаждается ионом S2–из растворов всех его соединений. Образование этого сульфида происходит также при действии содержащего следы H2 S воздуха (что обычно для городов) на металлическое серебро. Реакция по уравнению
4Ag+2H2 S + O2 = 2Ag2 S + 2H2 O
медленно идет уже в обычных условиях и обусловливает постепенное потемнение серебряных предметов.
Из соединений, в которых элементы подгруппы меди двухвалентны, хорошо изучены и имеют практическое значение только производные самой меди. Черная окись меди (CuО) иногда встречается в природе и легко может быть получена накаливанием Cu на воздухе. В воде она практически нерастворима, а в кислотах растворяется, образуя соответствующие соли.
Отвечающий окиси меди гидрат [Cu(ОН)2 ] выделяется в виде голубого осадка при действии щелочи на растворы солей Cu2+ В воде он практически нерастворим, а при нагревании легко отщепляет воду и переходит в CuО.
Для гидроокиси меди характерны довольно слабо выраженные основные свойства. С кислотами она образует соли, большинство которых хорошо растворимо в воде. В разбавленных растворах цвет всех солей двухвалентной меди с бесцветными анионами сине–голубой (цвет иона Cu2+). Напротив, окраска твердых солей Cu2+ различна. В частности, наиболее практически важная из них – медный купорос (CuSO4 ·5H2 O) – имеет синий цвет.
Комплексообразование для двухвалентной меди весьма характерно. Это видно уже из того, что почти все соли Cu2+ выделяются из растворов в виде кристаллогидратов. С соответствующими солями щелочных металлов соли Cu2+ дают двойные соединения, содержащие медь в составе комплексных анионов (например, [CuСl4 ]2–). Однако большинство последних неустойчиво и в растворе распадается на составные части. Значительно Устойчивее очень характерный для двухвалентной меди темно–синий комплексный катион [Cu(NH3 )4 ]2+, образующийся при прибавлении избытка аммиака к растворам солей Cu2+ по реакции, например:
CuSO4 + 4NH4 OH = [Cu(NH3 )4 ]SO4 + 4Н2 О
В связи с интенсивной окраской этого комплекса аммиаком можно пользоваться как реактивом на медь.
11) В избытке концентрированного раствора сильной щелочи гидроокись меди растворима вследствие образования синих купритов (NаНCuО2 , Na2 CuO2 и т. п.). Однако последние весьма неустойчивы и при разбавлении раствора разлагаются с выделением Cu(ОН)2 . Это показывает, что кислотные свойства гидроокиси меди выражены очень слабо.
12) Примером немногочисленных производных двухвалентного серебра может служить AgF2 , образующееся при действии фтора на мелко раздробленное Ag. Оно представляет собой коричнево–черное вещество, плавящееся около 690 °С. Водой AgF2 тотчас разлагается с образованием AgF, HF и кислорода (со значительным содержанием озона).
13) При действии сухого хлора на порошок Au с большим выделением тепла образуется темно–красное соединение, отвечающее эмпирической формуле AuСl2 . Известно также несколько других производных Au (темно–зеленый AuО и т. д.), формально отвечающих двухвалентному золоту. В действительности все они являются комплексными соединениями, содержащими одновременно одно– и трехвалентное золото: AuI[AuIIIО4 ), AuI[AuIIIO2 ] и т. д.
Из соединений трехвалентных элементов подгруппы меди хорошо изучены только производные Au. Удобным исходным продуктом для их получения служит коричнево–красное хлорное золото (AuСl3 ), образующееся около 200°С при действии избытка хлора на порошок Au.
Окись золота (Au2 O3 ) может быть получена только косвенным путем. Она представляет собой нерастворимый в воде темно–коричневый порошок, легко отщепляющий кислород при нагревании.
Красно–бурая, гидроокись [Au(ОН)3 ] осаждается при действий сильных щелочей на раствор AuСl3 . Она амфотерна, причем кислотная ее функция выражена сильнее основной.
Соли Au(ОН)3 с основаниями – аураты – образуются при его растворении в сильных щелочах и производятся от комплексной кислоты HfAu(OH)4 ]– Соли, отвечающие основной функции Au(ОН)з, могут быть получены растворением гидроокиси золота в сильных кислотах. Большинство производных трехвалентного золота окрашено, чаще всего в цвета желтых оттенков.
Характерной особенностью Au3+ является резко выраженная склонность его к образованию комплексных анионов. Например» при взаимодействии AuСl3 с водой по схеме
Н2 О + AuСl3 = Н2 [ОAuСl3 ]
получается коричнево–красный раствор аквокислоты (т. е. кислоты, образующейся за счет комплексного присоединения воды к нейтральной соли), дающей с ионами Ag желтый осадок труднорастворимой серебряной соли – Ag2 [OAuCl3 ].
Наиболее обычным соединением трехвалентного золота является золотохлористоводородная кислота, выделяющаяся в виде кристаллогидрата Н[AuСl4 ]·4Н2 О при упаривании раствора золота в насыщенной хлором НСl. Как сама она, так \\ многие ее соли (хлораураты) хорошо растворимы не только в воде, но и в некоторых органических растворителях (спирт, эфир)– Очень малой растворимостью хлораурата цезия пользуются иногда для открытия этого элемента.
14) Производные трехвалентных серебра и меди изучены сравнительно мало. В частности, нагреванием смеси КСl с CuС2 в атмосфере фтора был получен зеленый комплекс К3 [CuF6 ]. И для Cu3+ и для Ag3+известны также производные ортоиодной и ортотеллуровой кислот.
При сопоставлении элементов обеих подгрупп I группы между теми и другими можно наметить лишь немногие черты сходства. В частности, все металлы I группы отличаются высокой электропроводностью и образуют соединения, в которых они одновалентны. Однако Li и его аналоги только одновалентны, между тем как элементы подгруппы меди способны проявлять (а в случаях Cu и Au даже предпочтительно проявляют) более высокую валентность. В этом отношении несколько ближе других элементов подгруппы меди стоит к щелочным металлам серебро.


