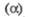Цезий
ЦЕЗИЙ [от лат. caesius - голубой (по ярко-синим спектр. линиям); лат. Cesium] Cs, хим. элемент I гр. периодич. системы, ат. н. 55, ат. м. 132,9054; относится к щелочным металлам. Природный цезий состоит из стабильного нуклида 133Cs. Поперечное сечение захвата тепловых нейтронов 2,9 х 10-27 м2. Конфигурация внеш. электронной оболочки атома 6s1; степень окисления +1; энергия ионизации при переходе Cs° Cs+
Cs+ Cs2+ соотв. 3,89397, 25,1 эВ; сродство к электрону 0,47 эВ; электроотрицательность по Полингу 0,7; работа выхода электрона 1,81 эВ; металлич. радиус 0,266 нм, кова-лентный радиус 0,235 нм, ионный радиус Cs+ 0,181 нм (координац. число 6), 0,188 нм (8), 0,192 нм (9), 0,195 нм (10), 0,202 нм (12).
Cs2+ соотв. 3,89397, 25,1 эВ; сродство к электрону 0,47 эВ; электроотрицательность по Полингу 0,7; работа выхода электрона 1,81 эВ; металлич. радиус 0,266 нм, кова-лентный радиус 0,235 нм, ионный радиус Cs+ 0,181 нм (координац. число 6), 0,188 нм (8), 0,192 нм (9), 0,195 нм (10), 0,202 нм (12).
Содержание цезия в земной коре 3,7 x 10-4% по массе. Минералы цезия- поллуцит (Cs, Na)[AlSi2O6] x nН2О (содержание Cs2O 29,8-36,7% по массе) и редкий авогадрит (К, Cs)[BF4]. Цезий присутствует в виде примеси в богатых калием алюмосиликатах: лепидолите (0,1-0,5% Cs2O), флогопите (0,2-1,5%) и др., также в карналлите (0,0003-0,002% CsCl), трифилине, в термальных (до 5 мг/л Cs) и озерных (до 0,3 мг/л Cs) водах. Пром. источники цезия- поллуцит и лепидолит. Осн. месторождения поллуцита находятся в Канаде, Намибии, Зимбабве. Перспективные сырьевые источники: нефелиновые руды, карналлит, цезиевый биотит, флогопит и др. слюды и слюдяные хвосты, получаемые при разработке берилловых, фенакитовых, флюоритовых месторождений, а также высокоминерализованные термальные воды.
Свойства. Цезий- мягкий серебристо-белый металл, при комнатной т-ре находится в полужидком состоянии. Пары окрашены в зеленовато-синий цвет. Кристаллизуется в кубич. объемноцентрированной решетке: а = 0,6141 нм, z = 2, пространств. группа Im3m; т. пл. 28,44 °С, т. кип. 669,2 °С; плотн. 1,904 г/см3 (20 °С);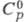 32,21 Дж/(моль x К);
32,21 Дж/(моль x К);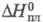 2,096 кДж/моль,
2,096 кДж/моль,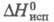 65,62 кДж/моль,
65,62 кДж/моль, 76,54 кДж/моль (298,15 К);
76,54 кДж/моль (298,15 К);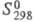 85,23 Дж/(моль x К); ур-ния температурной зависимости давления пара: lgp (мм рт. ст.) = -4122/T+ 5,228 - 1,514 lgT + 3977T (100-301,59 К), lgp (мм рт. ст.)= -3822/T + 4,940 - 0,746 lgТ (301,59-897 К); теплопроводность, Вт/(м x К): 19,0 (298 К), 19,3 (373 К), 20,2 (473 К);
85,23 Дж/(моль x К); ур-ния температурной зависимости давления пара: lgp (мм рт. ст.) = -4122/T+ 5,228 - 1,514 lgT + 3977T (100-301,59 К), lgp (мм рт. ст.)= -3822/T + 4,940 - 0,746 lgТ (301,59-897 К); теплопроводность, Вт/(м x К): 19,0 (298 К), 19,3 (373 К), 20,2 (473 К);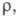 мкОм x м: 0,1830 (273,15 К), 0,2142 (301,59 К, твердый), 0,3568 (301,59 К, жидкость), температурный коэф.
мкОм x м: 0,1830 (273,15 К), 0,2142 (301,59 К, твердый), 0,3568 (301,59 К, жидкость), температурный коэф.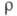 6,0 x 10-3 К-1 (273-291 К); парамагнетик, уд. магн. восприимчивость +0,22 x 10-9 (293 К);
6,0 x 10-3 К-1 (273-291 К); парамагнетик, уд. магн. восприимчивость +0,22 x 10-9 (293 К);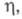 мПа x с: 6,76 (301,59 К), 5,27 (350 К), 3,18 (500 К);
мПа x с: 6,76 (301,59 К), 5,27 (350 К), 3,18 (500 К);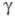 60,6 мН/м (301,59 К); температурный коэф. линейного расширения 97 x 10-6 К-1 (273 К); твердость по Моосу 0,2; модуль упругости 1,7 ГПа (293 К); коэф. сжимаемости 71 x 10-11Па-1 (323 К).
60,6 мН/м (301,59 К); температурный коэф. линейного расширения 97 x 10-6 К-1 (273 К); твердость по Моосу 0,2; модуль упругости 1,7 ГПа (293 К); коэф. сжимаемости 71 x 10-11Па-1 (323 К).
Цезий химически очень активен. Стандартный электродный потенциал -2,923 В. На воздухе мгновенно окисляется с воспламенением, образуя надпероксид CsO2 с примесью пероксида Cs2O2. При ограниченном доступе О2 окисляется до цезия оксида Cs2O; CsO2 переходит в озонид CsO3 в токе озонированного О2 при 40 °С. С водой цезий реагирует со взрывом с образованием гидроксида CsOH и выделением Н2. Взаимод. с сухим Н2 при 200-350 °С под давлением 5-10 МПа или в присут. катализатора с образованием гидрида CsH. Горит в атмосфере галогенов, давая цезия галогениды. Сульфиды Cs2Sn (n = 1-6) получают взаимод. металла с S в жидком NH3. Селенид Cs2Se и теллурид Cs2Te синтезируют сплавлением цезия соотв. с Se и Те в вакууме. С N2 в обычных условиях цезий не взаимод., с жидким N2 при электрич. разряде между электродами, изготовленными из цезия, образует нитрид Cs3N. Цезий раств. в жидком NH3, алкиламинах и полиэфирах, образуя синие р-ры, обладающие электронной проводимостью; в аммиачном р-ре цезий медленно реагирует с NH3 c выделением Н2 и образованием амида CsNH2. С газообразным NH3 при 120 °С образует CsNH2, с красным Р в вакууме при 400-430 °С - фосфид Cs2P5, с порошком графита при 200-500 °С- карбид C8Cs, а при более высоких т-рах - C24Cs, C36Cs и др. карбиды, с ацетиленом при 300 °С в вакууме - ацетиленид Cs2С2, с Si и Ge в атмосфере Аr при 600 °С - соотв. силицид CsSi и германид CsGe. Цезий взаимод. с СО2, ССl4 со взрывом. Выше 300 °С разрушает стекло, восстанавливая Si из SiO2 и силикатов. Цезий реагирует со всеми к-тами с образованием соответствующих солей, со спиртами дает алкоголяты. Св-ва соед. цезия представлены в табл.
ХАРАКТЕРИСТИКА НЕКОТОРЫХ СОЕДИНЕНИЙ ЦЕЗИЯ
| Показатель | CsH | СsO3 | CsOH | Cs2SO4 | CsNO3 | Cs2CO3 | CsN3 | ||||
| Цвет | Бесцв. | Оранжево-красный | Бесцв. | Бесцв. | Бесцв. | Бесцв. | Желтоватый | ||||
| Сингония | Кубич. | Тетрагон. | Ромбич. | Кубич. | Ромбич.
| Гексагон.
| Гексагон. | — | Тетрагон. | Кубич. | |
| Т. пл., °С | 528 | 82а | 224е | 343 | 647б | 1015 | 154е | 793 | 151* | 326 | |
| Плота. (25 oС), г/см3 | 3,42 | 3,19 | 3,675 (11 °С) | — | 4,246 (20 °С) | — | 3,643 (20 °С) | _ | _ | ||
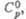 Дж/(моль x К) Дж/(моль x К) | 40,6 | 83,7 | 73 | — | 134,9 | — | 96,1 | 123,9 | 83 ,23 | — | |
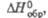 кДж/моль кДж/моль | -54,0 | -271,1 | -416,6 | 7,1' | -1442,9 | — | -505,0 | -1134,9 | -19,6 | 3,22в | |
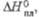 кДж/моль кДж/моль | 15 | — | — | 7,3 | — | 35,1 | — | 31 | — | — | |
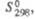 Дж/(моль К) Дж/(моль К) | 73 | 134 | 102,6 | — | 211,9 | — | 153,8 | 204,5 | 134,4 | — | |
| Р-римость в воде, г в 100 г | Разлагается с вьщеле-нием Н2 | Разлагается с выделением О2 | 385,6 (15 °С) 303 (30 °С) | 178,7 (20 °С) 210,3 (80 °С) | 23,0 (20 °С) 134 (80 °С) | 308,3 (20 °С) | 224,2 (0 оС) 307,4 (16 °С) | ||||
а Т-ра разложения. бТ-ра полиморфного перехода. в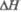 полиморфного перехода.
полиморфного перехода.
Цезий образует твердые р-ры с К и Rb, эвтектич. смесь с Na, не смешивается с Li. Со мн. металлами дает интерметаллиды, напр. CsAu, CsSn4.
Получение. Для извлечения цезия из поллуцита используют след. методы: кислотные, спекание и сплавление, прямое получение металлич. цезия. В кислотных методах применяют галогеноводородные к-ты (чаще соляную) или H2SO4. Поллуцит разлагают конц. соляной к-той при натр., из полученного р-ра действием SbCl3 осаждают Cs3[Sb2Cl9], к-рый обрабатывают горячей водой или р-ром NH3 с образованием CsCl. При разложении поллуцита серной к-той получают алюмоцезиевые квасцы CsAl(SO4)2 x 12H2O.
Из методов спекания и сплавления наиб. распространен метод Аренда: поллуцит спекают со смесью СаО и СаС12, спек выщелачивают в автоклаве горячей водой, р-р упаривают досуха с H2SO4 для отделения CaSO4, остаток обрабатывают горячей водой; из полученного р-ра осаждают Cs3[Sb2Cl9]. Прямое извлечение металлич. цезия осуществляют путем нагревания до 900 °С в вакууме смеси (1:3) измельченного поллуцита и Са (или Аl).
Цезий из лепидолита получают попутно при его переработке на соед. лития. Цезий осаждают из маточных р-ров после выделения Li2CO3 или LiOH в виде смеси алюмоцезиевых, алюморубидиевых и алюмокалиевых квасцов.
Для разделения Cs, Rb и К и получения чистых соед. цезия применяют методы фракционированной кристаллизации квасцов и нитратов, осаждения и перекристаллизации Cs3[Sb2Cl9], Cs2[SnCl6]. Используют также ионообменную хроматографию на синтетич. смолах и неорг. ионитах (клиноптилолит и др.), экстракцию производными фенола [4-втор-бутил-2-(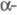 метилбензил)фенол, алкилфенолы С7-С9 и др.]. Для получения соед. цезия высокой чистоты применяют его полигалогениды.
метилбензил)фенол, алкилфенолы С7-С9 и др.]. Для получения соед. цезия высокой чистоты применяют его полигалогениды.
Извлечение радиоактивного изотопа 137Cs (Т1/2 33 г, продукт деления U в ядерных реакторах) из р-ров, полученных при переработке радиоактивных отходов ядерных реакторов, осуществляют методами соосаждения с гексацианоферратами Fe, Ni, Zn или фосфоровольфраматом аммония, ионного обмена на гексацианоферрате Ni, фосфоровольфрамате аммония и др., экстракционным.
Металлич. цезий получают в осн. металлотермии, восстановлением CsCl (кальцием или магнием, 0,1-10 Па, 700-800 °С) с послед. очисткой от примесей ректификацией и вакуумной дистилляцией. По др. способу проводят электролиз расплава CsHal с жидким свинцовым катодом и получают сплав Cs-Pb, из к-рого выделяют металлич. цезий дистилляцией в вакууме. Цезий высокой чистоты получают медленным термич. разложением CsN3 в вакууме (менее 10 Па, 390-395 °С).
Определение. Качественно цезий обнаруживают по характерным линиям спектра 894,35 нм и 852,11 нм. Для микрохим. обнаружения используют осаждение Cs3[Sb2Cl9], Cs3[Bi2I9], Cs[SnI5] и др. менее избирательные р-ции. Наиб. распространенные методы определения микроколичеств цезия- эмиссионная пламенная фотометрия и атомно-абсорбционная спектрометрия. Применяют также радиохим. метод изотопного разбавления и нейтронно-активационный анализ.
При высоком содержании цезия в пробе его определяют гравиметрически в виде Cs[B(C6H5)4], Cs[Bi2I9,], Cs2[TeI6], Cs3[Co(NO2)6] и нек-рых др. солей. В гораздо меньшей степени используют титриметрич. и спектрофотометрич. методы.
Применение. Металлич. цезий- компонент материала катодов для фотоэлементов, фотоэлектронных умножителей, телевизионных передающих электронно-лучевых трубок, термоэмиссионных электронно-оптич. преобразователей. Цезий используют в вакуумных электронных приборах (как геттер), выпрямителях, атомных стандартах времени. Цезиевые "атомные часы" необыкновенно точны. Их действие основано на переходах между двумя состояниями атома цезия- с параллельной и антипараллельной ориентацией собств. магн. моментов ядра атома и валентного электрона; этот переход сопровождается колебаниями со строго постоянными характеристиками (длина волны 3,26 см). Пары цезия- рабочее тело в магнитогидродинамич. генераторах, газовых лазерах, ионных ракетных двигателях. Радионуклид 137Cs используют для g-дефектоскопии, в медицине для диагностики и лечения. Цезий-теплоноситель в ядерных реакторах, компонент смазочных материалов для космич. техники.
Мировое произ-во цезия и его соединений (без СНГ) ок. 10 т в год.
Хранят цезий в ампулах из стекла пирекс в атмосфере Аr или стальных герметичных сосудах под слоем обезвоженного масла (вазелинового, парафинового). Утилизируют обработкой остатков металла пентанолом.
СВОЙСТВА ГАЛОГЕНИДОВ ЦЕЗИЯ
| Показатель | СsF | CsHF2 | CsCl | CsBr | CsI | ||||||
| Сингония | Кубич.а | Тетрагон. | Кубич. | Кубич. | Кубич. | Кубич. | Кубич. | Кубич. | Кубич. | Кубич. | |
| Параметр кристаллич. решетки а, нм | 0,601 | 0,614б | 0,412 | — | 0,411 | 0,694 | 0,429 | 0,723 | 0,457 | 0,766 | |
| Число формульных единиц в ячейке | 4 | — | 1 | — | 1 | 4 | 1 | 4 | 1 | 4 | |
| Пространств. группа | FтЗт | I4/тст | Рт3т | _ | Рт3т | Fm3m | Рт3т | Fт3т | Рт3т | Fт3т | |
| Т. пл., °С | 703 | 58в | 177в | 180 | 470в | 646 | _ | 637 | _ | 632 | |
| Т. кип., °С | 1253 | _ | _ | _ | _ | 1295 | _ | 1297 | _ | 1280 | |
| Плотн. (25 °С), г/см3 | 3,59г | 3,68 | 3,81 | _ | 3.983 | _ | 4,43 | _ | 4,509 | _ | |
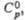 Дж/(моль х К) Дж/(моль х К) | 51,09 | 87,34 | — | 52,47 | — | 52,93 | — | 52,47 | — | ||
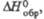 кДж/моль кДж/моль | -557,1 | -923 ,2 | 4,15д | — | -442,3 | 2,93д | -405,6 | — | -348,1 | — | |
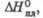 кДж/моль кДж/моль | 21,7 | 2,43д | — | 2,76 | — | 20,38 | — | 23,6 | — | 25,65 | |
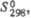 Дж/(моль х К) Дж/(моль х К) | 92,96 | 135,3 | — | — | 101,17 | — | 112,94 | — | 122,20 | — | |
| Показатель преломления при 20 °С( 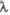 589 нм) 589 нм) | 1,480 | — | — | — | 1,6397 | — | 1,6984 | — | 1,7876 | — | |
а Гранецентрир., при высоких давлениях существует объемноцентрир. кубич. модификация. б с = 0,784 нм. вТ-ра полиморфного перехода. г При 20 оС. полиморфного перехода.
полиморфного перехода.
Цезий открыли Р. Бунзен и Г. Кирхгоф в 1861; впервые выделил металлич. цезий в 1882 К. Сеттерберг.
Лит.: Плющев В. Е., Степин Б. Д., Химия и технология соединений лития, рубидия и цезия, М., 1970; Коган Б.И., Названова В. А., Солодов Н.А., Рубидий и цезий, М., 1971; Плющев В. Е., Степин Б.Д., Аналитическая химия рубидия и цезия, М., 1975; Мозговой А. Г. [и др.], в кн.: Обзоры по теплофизическим свойствам веществ, М., 1985, № 1, с. 3-108; Степин Б. Д., Цветков А.А., Неорганическая химия, М., 1994; Hart W. А. [а. о.], The chemistry of lithium, sodium, potssium, rubidium, cesium and francium, Oxf., 1975.
Л. И. Покровская.