Система цитохрома Р450
На первой фазе биотрансформации менее реакционноспособные соединения подвергаются ферментативному гидроксилированию. Такая модификация делает возможной последующую конъюгацию с полярным веществом. Вообще гидроксилирующие ферменты являются монооксигеназами, включающими в качестве кофермента железосодержащий гем. Восстановленная форма гема связывает оксид углерода (СО) и приобретает характерное поглощение света при 450 нм. Поэтому такая группа ферментов носит название цитохромы Р450 (цитР450).
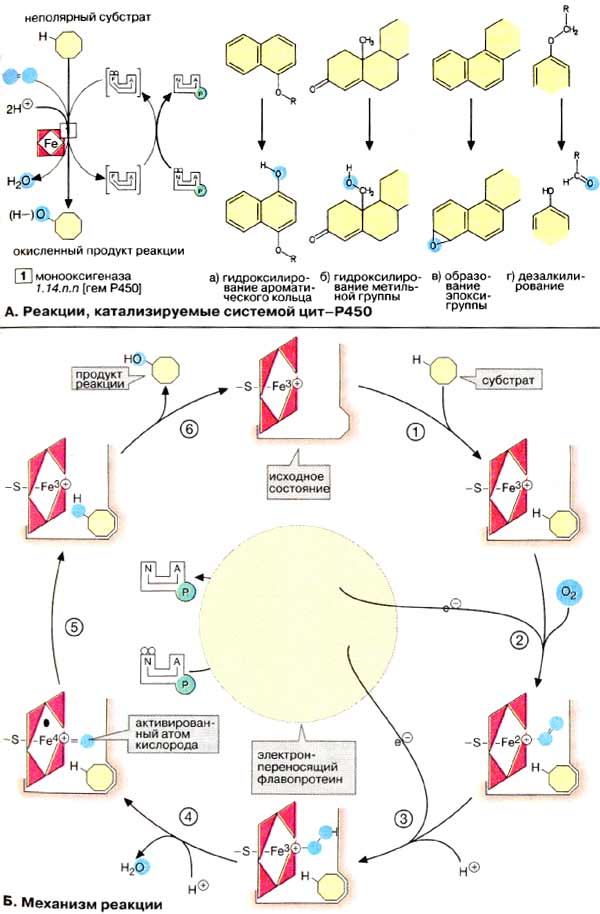
Система цитР450 принимает участие во многих процессах обмена веществ, например в биосинтезе стероидных гормонов (см. сс. 174, 364), желчных кислот и эйкозаноидов, а также в образовании ненасыщенных жирных кислот.
А. Реакции, катализируемые системой цитР450
ЦитР450-зависимые монооксигеназы катализируют расщепление веществ разного типа с участием НАДФН и молекулярного кислорода (О2). При этом один атом кислорода присоединяется к субстрату, а второй освобождается в составе молекулы воды. В реакции принимает участие флавопротеин, выполняющий функцию переносчика восстановительного эквивалента с кофермента НАДФН + Н+ на собственно монооксигеназу, которая переносит электроны на молекулярный кислород.
В печени, а также в железах, продуцирующих стероидные гормоны, и в других органах встречаются разные формы фермента цитР450. Субстратная специфичность фермента печени невелика. Наиболее эффективно он катализирует окисление неполярных соединений с алифатическими или ароматическими кольцами. К ним относятся эндогенные субстраты организма, например стероидные гормоны, а также лекарственные вещества, инактивированные путем модификации. Превращение этилового спирта в печени также катализирует фермент цитР450 («микросомальная система окисления этанола», см. с. 312). Так как спирт и лекарственные вещества являются субстратами одной и той же ферментативной системы, их совместное воздействие на организм может быть опасным для жизни. Поэтому фермент цитР450 представляет особый интерес для фармакологии.
Из множества цитР450-зависимых реакций здесь приводится только несколько примеров. Гидроксилирование ароматического кольца (а) играет центральную роль в метаболических превращениях медицинских препаратов и стероидов. При этом ангулярные метильные группы могут окисляться до гидроксиметильных (б). Эпоксидирование (в) приводит к высокореакционноспособным и часто токсичным продуктам. Примером является биотрансформация бензпирена в эпоксид, обладающий мутагенным действием. ЦитР450-зависимая реакция дезаминирования (г) приводит к отщеплению алкильных заместителей при гетероатомах (О, N или S) в виде альдегидов.
Б. Каталитический цикл
Ход каталитической реакции с участием цитР450 в принципе известен. Решающая роль группы гема состоит в том, что она переводит атомарный кислород в реакционно-способную форму, которая собственно и ответственна за все описанные выше реакции. В исходной стадии атом железа трехвалентен. Цитохром связывает субстрат рядом с группой гема (1). Это делает возможным восстановление трехвалентного железа до двухвалентной формы и последующее присоединение молекулы О2 (2). Далее следует перенос электронов (3) и окисление атома железа, который восстанавливает связанный кислород в пероксид. От промежуточного продукта отщепляется ион гидроксила (4) с образованием молекулы воды и реакционноспособной формы кислорода. В этом радикале железо формально четырехвалентно. Активированный атом кислорода атакует связь С-Н субстрата с образованием гидроксигруппы (5). После освобождения продукта реакции (6) фермент возвращается в исходное состояние.


