Хлороформ
Синонимы:
трихлорметан
Внешний вид:
бесцветн. подвижная жидкостьБрутто-формула (система Хилла): CHCl3
Формула в виде текста: HCCl3
Молекулярная масса (в а.е.м.): 119,38
Температура плавления (в °C): -63,5
Температура кипения (в °C): 61,15
Температурные константы смесей:
56,2 °C (температура кипения азеотропа, давление 1 атм) вода 2,6% хлороформ 97,4%
Растворимость (в г/100 г или характеристика):
ацетон: растворимбензол: растворим
вода: 1 (15°C)
диэтиловый эфир: смешивается
жирные масла: смешивается
лигроин: смешивается
сероуглерод: растворим
этанол: смешивается
Вкус, запах, гигроскопичность:
вкус: жгучийзапах: характерный
Метод получения 1.
(лабораторный синтез)Источник информации: "Лабораторные работы по органической химии" под ред. Гинзбурга В.Ф., М.:Высшая школа, 1974 стр. 72-73
Прибор для получения хлороформа состоит из колбы Вюрца на 1 л, снабженной капельной воронкой (конец капельной воронки должен быть ниже уровня жидкости в колбе), водяного холодильника, алонжа и колбы Вюрца на 100 мл, служащей приемником.
100 г хлорной извести (35% активного хлора), предварительно тщательно растертой с 250 мл воды, помещают в реакционную колбу. В капельную воронку наливают смесь 16 мл ацетона и 16 мл воды. В приемник наливают 5 мл воды, слой которой должен предохранять отогнанный хлороформ от испарения. Затем из капельной воронки в колбу по каплям приливают около 5 мл раствора ацетона и осторожно нагревают колбу на асбестовой сетке. Содержимое колбы начинает пениться и в приемник отгоняется хлороформ. Если реакция идет слишком бурно и возможен переброс реакционной смеси из колбы в приемник, следует прекратить нагревание и охладить колбу в бане с холодной водой. Следующие порции ацетона приливают по мере отгонки образовавшегося хлороформа. После добавления всего количества ацетона колбу нагревают до тех пор, пока отгоняющийся дистиллят не станет прозрачным.
Хлороформ отделяют от воды в делительной воронке, промывают 2%-ным раствором едкого натра, затем водой, сушат над сульфатом натрия и перегоняют.
Выход 60% от теоретического.
Плотность:
1,488 (20°C, г/см3)Показатель преломления (для D-линии натрия):
1,4455 (20°C)Давление паров (в мм.рт.ст.):
1 (-58,9°C)10 (-30,4°C)
30 (-13,1°C)
100 (9,8°C)
400 (42,7°C)
Показатель диссоциации:
pKa (1) = 15,7 (20 C, вода)Диэлектрическая проницаемость:
4,806 (20°C)Дипольный момент молекулы (в дебаях):
1,15 (20°C)Динамическая вязкость жидкостей и газов (в мПа·с):
0,542 (25°C)Поверхностное натяжение (в мН/м):
27,14 (20°C)Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-131,8 (ж)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-71,1 (ж)Стандартная энтропия образования S (298 К, Дж/моль·K):
202,9 (ж)Стандартная мольная теплоемкость Cp (298 К, Дж/моль·K):
116,3 (ж)Теплота сгорания Qp (кДж/моль):
373,2Механизм действия:
Механизм анестетического действия связывают с уменьшением температуры фазового перехода некоторых липидов мембран и, таким образом, увеличивается текучесть мембран нервных клеток.
Аналитические
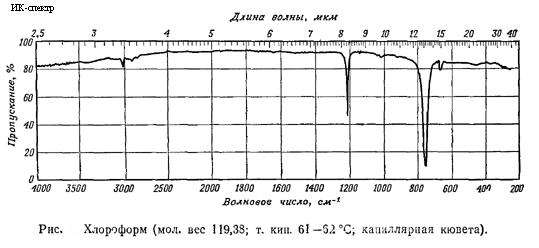
Критическая температура (в °C):
262Критическое давление (в МПа):
5,53Дополнительная информация:
Нельзя сушить натрием.
- "Справочник химика" т.1, Л.-М.: Химия, 1963 стр. 617
- Беликов В.Г. "Учебное пособие по фармацевтической химии" М.: Медицина, 1979 стр. 92
- Гордон А., Форд Р. "Спутник химика" М.: Мир, 1976 стр. 187
- Рабинович В.А., Хавин З.Я. "Краткий химический справочник" Л.: Химия, 1977 стр. 193
- Химия и Жизнь №5 1990 стр. 82
- Хухо Ф. "Нейрохимия: Основы и принципы" М.: Мир, 1990 стр. 74