ОКСИМЫ, производные
альдегидов или кетонов (соотв. альдоксимы RCH=NOH или кетоксимы RR'C=NOH, где
R, R'-opr. радикалы). Оксимы-жидкости или низкоплавкие твердые в-ва (см. табл.),
хорошо раств. во многих орг. р-рителях, плохо-в холодной воде. Оксимы альдегидов
и несимметричных кетонов существуют в виде двух стереоизомерных форм, напр.
для бензальдоксима син- (Е, ф-ла I) и анти- (Z, II), к-рые могут
существенно различаться по св-вам. Взаимные превращ. стереоизомеров осуществляются
при действии к-т или при облучении.

СВОЙСТВА НЕКОТОРЫХ ОКСИМОВ
|
Соединение |
Мол. м. |
Т. пл., °С |
Т.кип., °С |
||
|
Формальдоксим CH2=NOH |
45,042 |
_ |
84 |
||
|
Ацетальдоксим CH3CH=NOH |
59,068 |
47 |
115 |
||
|
Бензальдоксим C6H5CH=NOH |
121,134 |
|
|
||
|
син- (Е) |
|
36-7 |
200 |
||
|
анти- (Z) |
|
132 |
|
||
|
Глиоксим HON=CHCH=NOH |
88,072 |
178 (с разл.) |
Возгоняется |
||
|
Диметилглиоксим
HON=C(CH3)C(CH3)=NOH |
116,124 |
246 |
Возгоняется |
||
|
Ацетоксим (CH3)2C=NOH |
121,134 |
61 |
134,8 |
||
|
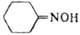
Циклогексаноноксим
|
113,158 |
90 |
206-210 |
||
ИК спектры оксимов имеют 2 слабые
полосы поглощения при 3650-3500 и 1690-1650 см -1, отвечающие валентным
колебаниям О—Н и C=N связей соотв., и сильную полосу при 960-930 см -1
(валентные колебания N—О-связи).
Оксимы - слабые к-ты и очень
слабые основания. При нагр. с водными р-рами к-т гидролизуются до RR'C=O и МН2ОН.
Взаимодействие оксимов со щелочами или алкоголятами щелочных металлов приводит к
солям RR'C=NOM, к-рые легко алкилируются с образованием О-алкильных производных;
эти же производные получаются из О-алкилгидроксилами-нов и карбонильных соед.,
напр.:
RR'C=NONa + R:I 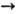 RR'C=NOR:
RR'C=NOR:
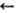 RR'CO +
NH2OR:
RR'CO +
NH2OR:
При алкилировании оксимов в
отсутствие оснований образуются нитроны, при галогенировании -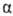 -галогеннитрозо-производные,
при нитровании - псевдонитролы:
-галогеннитрозо-производные,
при нитровании - псевдонитролы:
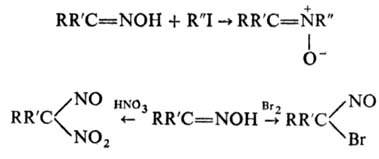
Кислотные агенты (полифосфорные
к-ты, РCl5 хлоран-гидриды сульфокислот и др.) превращают кетоксимы
и эфиры оксимов в амиды (см. Бекмана перегруппировка), а альдоксимы и
оксимы 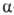 -гидроксикетонов
- в нитрилы, напр.:
-гидроксикетонов
- в нитрилы, напр.:
Оксимы вступают в р-ции присоединения
по связи C=N: с HCN образуют гидроксиаминонитрилы RR'C(CN)NHOH, при восстановлении-
N-алкилгидроксиламины и амины. Дегидрирование оксимов приводит к имтоксилъным
радикалам RR'C=NO•.
Получают оксимы обычно нагреванием
карбонильного соед. с гидрохлоридом гидроксиламина в присут. эквивалентного
кол-ва или избытка щелочи в водном или спиртовом р-ре; р-цию можно проводить
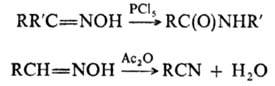
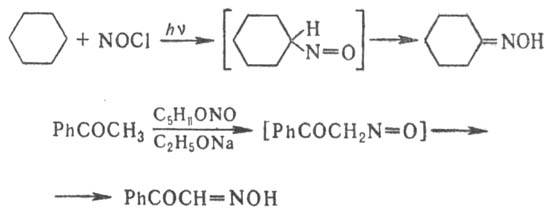
в среде пиридина в отсутствие щелочи, а иногда и в кислой среде. Оксимы получают
также нитрозированием нек-рых углеводородов или соед., содержащих активированную
метиленовую или метильную группу, напр.:
Иногда оксимы получают окислением
первичных аминов или восстановлением нитросоед.:
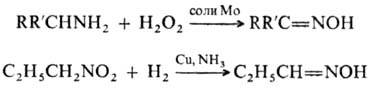
Образование оксимов используют
для выделения, идентификации и количеств. определения карбонильных соединений.
Нек-рые оксимы-аналит. реагенты, напр. диметилглиоксим применяют
для разделения и концентрирования Ni (II), Pd(II) и Re (IV), 1,2-диоксимы-для
определения Ni, Co, Сu и платиновых металлов, 2,2'-фурилдиоксим [1,2-(2-фурил)этандион-диоксим]-для
определения Pd в рудах, формальдоксим-реагент для фотометрия, определения Mn(III),
Ce(IV), V(V) в щелочной среде. Оксимы применяют для получения пестицидов (напр.,
бутокарбоксим, бутоксикарбоксим), лек. препаратов (напр., 2-пиридинальдоксимметиодид),
циклогексаноноксим-в произ-ве капролактама.
Лит.: Вейганд К.,
Методы эксперимента в органической химии, пер. с нем., ч. 2, М., 1950, с. 288;
Неницеску К. Д., Органическая химия, пер. с рум., т. 1, М., 1962; Органикум,
пер. с нем., т. 2, М., 1979, с. 61. Л. Г. Менчиков.