Молекулярные модели: инсулин
На схеме А приведена молекулярная модель небольшого белка инсулина. Строение, биосинтез и функции этого важнейшего гормона подробно обсуждаются в других разделах.
Чистый инсулин необходим а большом количестве для лечения диабета (Diabetes mellitus) — заболевания, которое чаще всего обусловлено абсолютным или относительным дефицитом инсулина в организме. В Германии ежегодный объем производства инсулина составляет более 500 кг. До недавнего времени гормон приходилось получать дорогостоящим и трудоемким способом из поджелудочной железы животных. Другой недостаток животного инсулина состоит в том, что при продолжительном применении он вызывает образование антител и гиперэргическую реакцию. Поэтому в последнее время инсулин человека стремятся получать с помощью суперэкспрессии гена инсулина в штаммах бактерий, трансформированных с помощью методов генной инженерии.
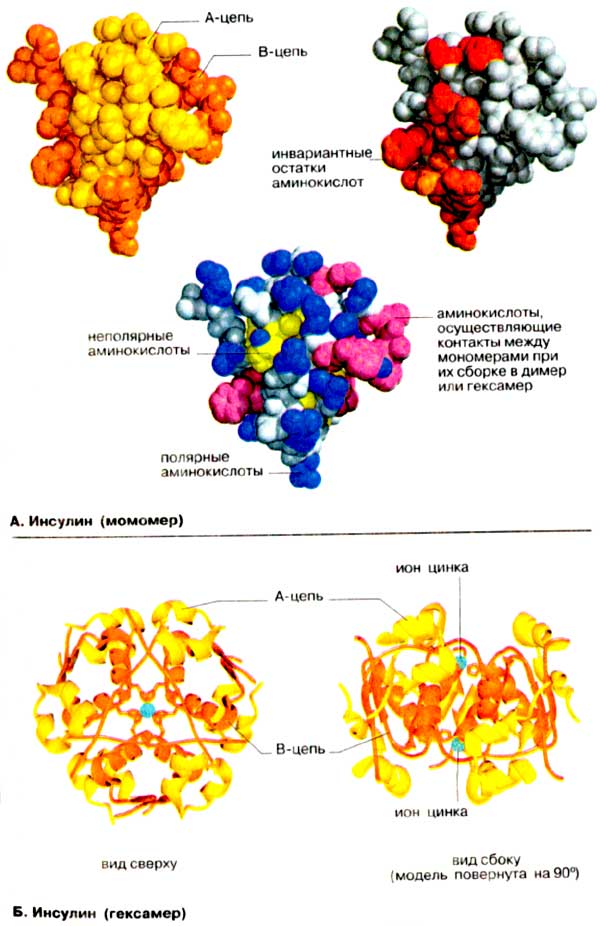
В качестве примера рассматривается молекула инсулина свиньи, который отличается от инсулина человека только одним аминокислотным остатком (вместо Аlа-30 в инсулине человека стоит треонин). На схеме А выделены наиболее существенные структурные элементы мономера инсулина, а на схеме Б показана схема упаковки гексамера в двух проекциях.
А. Инсулин (мономер)
Мономер инсулина состоит из 51 аминокислотного остатка, т. е. по молекулярной массе (5,5 кДа) он вдвое уступает самому низкомолекулярному ферменту. Тем не менее инсулин остается типичным глобулярным белком. В растворе инсулин имеет четвертичную структуру, которая существенна для его сигнальной функции. На приведенной слева вандерваальсовой модели A-цепь окрашена в желтый цвет, а В-цепь — в оранжевый. Известно, что молекула имеет клинообразную форму. Острие клина сформировано В-цепью, которая в этом месте меняет направление.
На модели (в центре) боковые группы полярных аминокислот (см. с. 66) окрашены в синий цвет, а неполярные группы — в желтый или красно-фиолетовый. Это сделано с тем, чтобы подчеркнуть важное значение гидрофобного эффекта в свертывании белков. Большинство гидрофобных боковых цепей находится внутри глобулы, в то время как гидрофильные группировки остаются на поверхности. Этому правилу явно противоречит присутствие на поверхности неполярных боковых групп (окрашены в красно-фиолетовый цвет). Однако все эти группы принимают участие в гидрофобных взаимодействиях, стабилизирующих димер и гексамер инсулина (см. Б)
На модели справа выделены остатки, которые лежат на поверхности и инвариантны (красный цвет) или почти инвариантны (оранжевый цвет) для инсулина любого происхождения. При этом принималось во внимание, что наиболее важными в функциональном отношении являются аминокислотные остатки, не претерпевшие изменений в ходе эволюции. В инсулине почти все инвариантные остатки сгруппированы на одной стороне молекулы. Предположительно, Эти аминокислоты принимают участие в связывании гормона с рецептором.
Б. Инсулин (гексамер)
До поступления в кровь инсулин накапливается В-клетками в островках Лангерганса в виде цинкосодержащего гексамера (см. с. 162). На схеме Б приведен гексамер (олигомер из 6 субъединиц) в упрощенном, ленточном, изображении. Как и на схеме А, A-цепь окрашена в желтый цвет, а В-цепь — в оранжевый. Гексамерная форма стабилизирована за счет образования комплекса с цинком, а котором принимают участие остатки гистидина в положении B-10 всех 6 субъединиц (см. с. 78, Г). Молекула (массой 33 кДа) имеет симметрию третьего порядка, что лучше всего видно при взгляде сверху (слева). Модель, повернутая на 90°. показывает, что два иона Zn2+ расположены на некотором расстоянии друг от друга.


