Биосинтез гема
Гем, железосодержащее тетрагидропиррольное красящее вещество, является составной частью О2-связывающих белков и различных коферментов оксидоредуктаз. Почти на 85% биосинтез гема происходит в костном мозге и лишь небольшая часть — в печени. В синтезе гема участвуют митохондрии и цитоплазма.
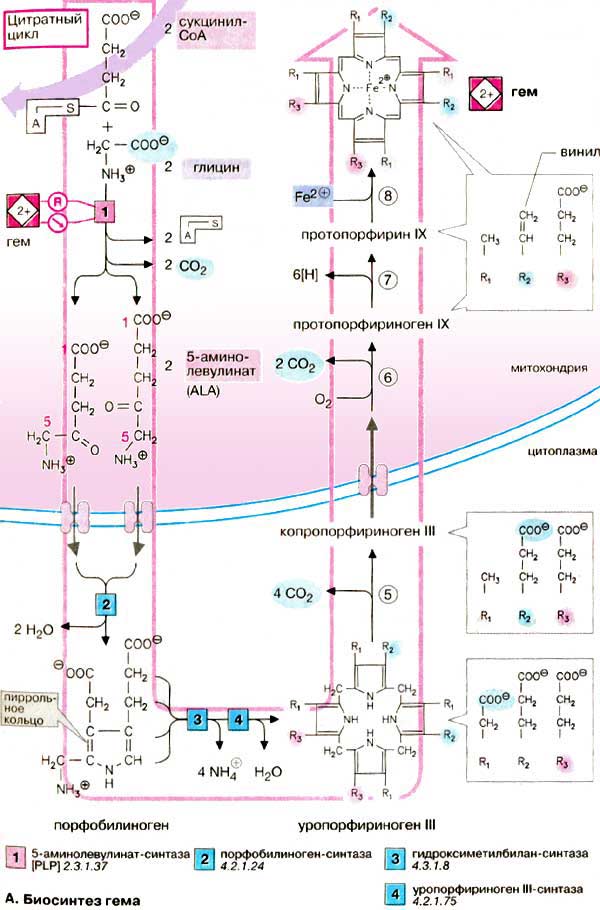
А. Биосинтез гема
Синтез тетрагидропиррольных колец начинается в митохондриях. Из сукцинил-КоА (на схеме наверху), промежуточного продукта цитратного цикла, конденсацией с глицином получается продукт, декарбоксилирование которого приводит к 5-аминолевулинату (ALA). Отвечающая за эту стадию 5-аминолевулинат-синтаза (ALA-синтаза) [1] является ключевым ферментом всего пути. Экспрессия синтеза ALA-синтазы тормозится гемом, т. е. конечным продуктом, и имеющимся ферментом. Это типичный случай торможения конечным продуктом, или ингибирования по типу обратной связи.
После синтеза 5-аминолевулинат переходит из митохондрий в цитоплазму, где две молекулы конденсируются в порфобилиноген, который уже содержит пиррольное кольцо [2]. Порфобилиноген-синтаза [2] ингибируется ионами свинца. Поэтому при острых отравлениях свинцом в крови и моче обнаруживают повышенные концентрации 5-аминолевулината.
На последующих стадиях образуется характерная для порфирина тетрапиррольная структура. Связывание четырех молекул порфобилиногена с отщеплением NH2-групп и образованием уропорфириногена III катализируется гидроксиметилбилан-синтазой [3]. Для образования этого промежуточного продукта необходим второй фермент, уропорфириноген III-синтаза [4]. Отсутствие этого фермента приводит к образованию «неправильного» изомера — уропорфириногена I.
Тетрапиррольная структура уропорфиринoгена III все еще существенно отличается от гема. Так, отсутствует центральный атом железа, а кольцо содержит только 8 вместо 11 двойных связей. Кроме того, кольца несут только заряженные боковые цепи R (4 ацетатных и 4 пропионатных остатков). Так как группы гема в белках функционируют в неполярном окружении, необходимо, чтобы полярные боковые цепи превратились в менее полярные. Вначале четыре ацетатных остатка (R1) декарбоксилируются с образованием метильных групп (5). Образующийся копропорфириноген III снова возвращается в митохондрии. Дальнейшие стадии катализируются ферментами, которые локализованы на/или внутри митохондриальной мембраны. Прежде всего под действием оксидазы две пропионатные группы (R2) превращаются в винильные (6). Модификация боковых цепей заканчивается образованием протопорфириногена IX.
На следующей стадии за счет окисления в молекуле создается сопряженная π-электронная система, которая придает гему характерную красную окраску. При этом расходуется 6 восстановительных эквивалентов (7). В заключение с помощью специального фермента, феррохелатазы, в молекулу включается атом двухвалентного железа (8). Образованный таким образом гем или Fe-протопорфирин IX включается, например, в гемоглобин и миоглобин, где он связан нековалентно, или в цитохром С, с которым связывается ковалентно.
Дополнительная информация
Известен ряд заболеваний, вызванных наследственными или приобретенными нарушениями порфиринового синтеза, так называемые порфирии; некоторые из них протекают очень тяжело. Многие из этих заболеваний приводят к выделению предшественников гема с калом или мочой, которая вследствие этого может быть окрашена в темно-красный цвет. Также наблюдается отложение порфиринов в коже. При воздействии света это приводит к образованию трудноизлечимых волдырей. При порфириях часты также неврологические нарушения. Возможно, что в основе средневековых легенд о людях-вампирах (дракулах) лежит странное поведение больных порфириями (светобоязнь, необычные внешность и поведение, употребление крови в пищу, компенсирующее дефицит гема и зачастую улучшающее состояние при некоторых формах порфирий).


