Производные угольной кислоты, содержащие серу. Сероуглерод
Аналогами угольного ангидрида, содержащими серу, являются сероуглерод CS2 и сероокись углерода COS.
При последовательном замещении кислорода серой в угольной кислоте можно было бы получить следующие кислоты: монотиоугольные

дитиоугольные

и тритиоугольную
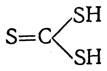
Эти тиоугольные кислоты могут образовывать соответствующие хлорангидриды, сложные эфиры, амиды и другие производные, хотя сами кислоты, подобно угольной кислоте, непрочны.
Сероуглерод CS2 получается непосредственно из элементов при пропускании паров серы над раскаленным углем. Реакция обратимая. В течение длительного времени это был основной промышленный метод получения сероуглерода. Он не утратил своего значения и до настоящего времени, но более экономичным является метод, основанный на взаимодействии природного метана с серой в паровой фазе над силикагелевым катализатором:
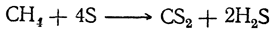
Окислением образующегося сероводорода сера регенерируется и возвращается в процесс.
Чистый сероуглерод представляет собой почти бесцветную, сильно преломляющую жидкость с эфирным, не очень неприятным запахом; относительная плотность 1,262 (при 20° С), т. кип. 46° С. Технический сероуглерод обладает противным запахом редьки. Пары сероуглерода воспламеняются при чрезвычайно низкой температуре, вследствие чего это вещество крайне огнеопасно.
Сероуглерод превосходно растворяет жиры и другие органические вещества, благодаря чему он находит значительное применение в качестве растворителя. В очень больших количествах сероуглерод потребляется в производстве вискозного искусственного волокна.
Сероуглерод довольно ядовит, особенно для низших животных. Он применяется для уничтожения вредных насекомых (например, для борьбы с вредителем виноградной лозы — филлоксерой).
При действии галоидов в присутствии катализаторов можно последовательно заместить в сероуглероде один или оба атома серы на атомы галоида и получить тиофосген CSCl2 или четыреххлористый углерод ССl4. Сера при этом превращается в хлористую серу S2Cl2.
Сероуглерод обладает свойствами тиоангидридов. Соединяясь с сернистыми металлами, он дает соли тритиоугольной кислоты:
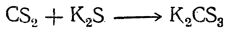
Из этих солей действием разбавленных кислот может быть выделена сама тритиоугольная кислота в виде маслянистой жидкости, разлагающейся на сероводород и сероуглерод. Калиевая соль тритиоугольной кислоты применяется для уничтожения филлоксеры.


