ФЕРРЕДОКСИН, железосодержащий
белок, выполняющий ф-ции переносчика электрона во мн. биол. окислит.-восста-новит.
процессах. Содержится во всех фотосинтезирующих клетках и тканях, в т. ч. в
хлоропластах высших растений.
Окраска ферредоксина определяется
поглощением при 465, 420 (e 9600), 390 и 278 нм. Ферредоксин оптически активен и
дает характерные спектры кругового дихроизма. Для восстановленной формы ферредоксина характерен
спектр ЭПР, наблюдаемый при 77К; среднее значение g-фактора ок. 1,94.
Ферредоксин- глобулярный белок,
его молекула в зависимости от источника состоит из 1, 3 или 4 полипептидных
цепей, содержащих по 95-100 аминокислотных остатков, из них 4-6 приходится на
цистеин; высокое содержание глутаминовой и аспарагиновой к-т определяет кислые
св-ва ферредоксина, рI ок.4. Мол. м. (8-24)· 103, типичное значение
ок. 104. Для мн. ферредоксинов из высших растений и водорослей известна первичная
структура и обнаружена высокая степень гомологии. Ряд ферредоксинов присутствует в клетках
в виде олигомерных структур.
Ферредоксин, как правило, мало устойчив
и должен храниться при низкой т-ре. Однако в вулканич. глубоководных областях
обнаружены содержащие ферредоксин термофильные архебактерии, напр. Pyrococcus furiosus,
сохраняющие св-ва после хранения 12 ч при 95 0C.
Все железо в окисленной
форме ферредоксина имеет степень окисления +3. Ферредоксин восстанавливается одноэлектронно, при
этом один атом Fe(III) переходит в состояние Fe(II). В состоянии Fе(II) - Fe(III)
ферредоксин- сильный восстановитель, типичное значение окислит.-восстановит. потенциала
-400 мВ.
Функцион. св-ва ферредоксина определяются
наличием активного центра (одного для "простых" ферредоксинов, двух для "сложных"),
структура к-рого представляет собой кластер, содержащий атом Fe, сульфидные
мостики S2- и остатки цистеина CH2S-, координированные
по атому Fe. Сера из сульфидных мостиков высвобождается при действии к-т, образуя
H2S.
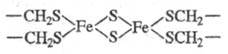
Ферредоксины могут содержать би-(см.
ф-лу), три- и тетраядерные кластеры. В биядерном кластере ферредоксина из Spirulina platensis
расстояние между атомами Fe составляет 0,272 нм. В окисленной форме кластер
содержит оба атома Fe(III) примерно в тетраэдрич. окружении. Структура в целом
диамагнитна, т.к. между атомами Fe, находящимися в высокоспиновом состоянии,
имеется антиферромагн. взаимод.; суммарный спин S = 0 при низких
т-рах. При комнатной т-pe возможно заселение возбужденных уровней (S=1), что
обнаруживается как парамагнитный сдвиг сигналов ПМР протонов, находящихся вблизи
металлокластера. При восстановлении одного атома Fe S= 1/2, что обусловливает
спектр ЭПР.
В фотосинтезе ферредоксин
осуществляет перенос электрона от фотосистемы I к никотинамидадениндифосфату,
он участвует также в восстановлении сульфита, нитрита, ненасыщенных жирных K-T,
поддержании активности фруктозо-1,6-дифосфа-тазы, пируватдекарбоксилазы и др.
Ферредоксин активен в ряде р-ций, в к-рых образуется или используется в качестве восстановителя
H2; партнером ферредоксина во мн. случаях выступают разл. гидрогеназы.
Разработаны способы удаления
кластеров из ферредоксинов, в т. ч. с сохранением их структуры, а также реконструкции ферредоксинов
как с собственными простетич. группами, так и с их синтетич. аналогами. Моделирование
активных центров ферредоксинов стимулировало синтез координац. соед. аналогичной структуры.
Лит.: Thomson A.J.,
в кн.: Metalloproteins, pt 1. Metal proteins with redox roles, ed. P. Harrison,
Weinheim - [a.o.], 1985, p. 79-120.
M. Г. Гольдфельд.