Кето-енольная таутомерия
Строение ацетоуксусного эфира было предметом спора среди химиков в течение многих десятилетий. На основании ряда химических реакций разные исследователи предлагали для него одну из следующих двух формул строения:
1) строение оксикротонового эфира
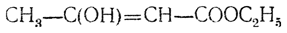
предложенное Гейтером, открывшим это соединение;
2) строение ацетоуксусного эфира
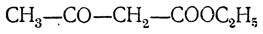
впервые предложенное Франкландом и Дюппа, открывшими ряд синтетических реакций, идущих при помощи этого эфира. В многочисленных исследованных реакциях ацетоуксусный эфир реагирует иногда так, как если бы он обладал строением эфира кетокислоты, а иногда в согласии с енольной формулой (как оксикротоновый эфир). Это — один из типичнейших примеров явления таутомерии, или десмотропии. Именно на этом примере особенно хорошо исследованы характерные взаимные отношения веществ, содержащих карбонильную группу >СН—СО—, к веществам, содержащим гидроксил у этиленовой связи >С=С(ОН)—, или енолам. Эти отношения носят название кето-енольной таутомерии.
Как мы видели раньше, для простейших альдегидов и кетонов и соответствующих ненасыщенных спиртов еще не наблюдаются явления настоящей таутомерии, так как простейшие енолы этого рода, подобные виниловому спирту, крайне неустойчивы, быстро и нацело превращаются в соединения с карбонильной группой, т. е. в альдегиды и кетоны. Устойчивы лишь производные таких енолов.
В более сложных молекулах превращение этих двух форм друг в друга иногда идет настолько медленно, что оказалось возможным проследить уже при обычных температурах ход этого превращения, а при низких температурах удалось выделить оба вещества в чистом виде.
Наиболее характерные отношения таутомерии наблюдаются при наличии в молекуле по крайней мере двух карбонильных групп, находящихся друг по отношению к другу в β-положении. Таковы ацетилацетон, малоновый эфир, ацетоуксусный эфир и пр.
Наличие в жидком ацетоуксусном эфире двух веществ может быть доказано следующим образом:
1. Как нам известно, многие физические характеристики вещества могут быть вычислены, если известна формула его строения. Особенно точно может быть вычислена молекулярная рефракция. Исследование плотности, молекулярной рефракции и других физических свойств показало, что величины этих констант для обыкновенного ацетоуксусного эфира лежат между теми, которые теоретически вычисляются для обеих форм. Зная величины этих констант для чистых веществ (на основании вычисления), можно было определить, в каких относительных количествах находятся обе формы. Изменение физических свойств свежеперегнанного ацетоуксусного эфира можно объяснить тем, что при комнатной температуре равновесие между обеими формами устанавливается сравнительно медленно.
2. Так как с хлорным железом интенсивное фиолетовое окрашивание дают только енолы, то по интенсивности окраски можно судить о большем или меньшем содержании енольной формы в таутомерной смеси. Количественное определение содержания енольной формы этим путем сделалось возможным лишь после выделения ее в чистом виде.
3. Как нашел К. Мейер, лишь енольная форма, подобно другим этиленовым соединениям, присоединяет бром; кето-форма реагирует с ним очень медленно. Таким образом, содержание енольной формы можно определить по количеству брома, присоединяющегося к смеси.
Содержание енольной формы может быть определено также методом Чугаева-Церевитинова. Ввиду сильного енолизирующего действия магнийорганических соединений на обычные кетоны более удобным оказалось применение цинкдиметила или цинкиодметила.
4. Наконец, Кнорру (1911) удалось, растворяя ацетоуксусный эфир в петролейном эфире и охлаждая раствор жидким воздухом, выделить из раствора кристаллическое вещество с т. пл. —39° С, оказавшееся чистой кето-формой, т. е. собственно ацетоуксусным эфиром. Свежеприготовленное вещество не давало реакции с хлорным железом, не присоединяло брома и обладало физическими свойствами, точно отвечающими кето-форме. При стоянии расплавленный чистый ацетоуксусный эфир медленно превращается в обыкновенный ацетоуксусный эфир.
Енольную форму, т. е. оксикротоновый эфир, Кнорру удалось получить, разлагая соляной кислотой при сильном охлаждении натрийацетоуксусный эфир, являющийся производным исключительно енольной формы. Полученный таким образом оксикротоновый эфир не представлял собой вполне индивидуального вещества, вероятно, потому, что здесь одновременно получались оба возможных (цис- и транс-) стереоизомера.
В отличие от кето-формы енольная форма моментально растворяется в щелочах, присоединяет теоретическое количество брома, дает интенсивную окраску с хлорным железом и т. п.
В обыкновенном ацетоуксусном эфире после установления равновесия содержится более 90% кето-формы и лишь несколько процентов енольной формы.
Разрешению вопроса о таутомерных формах ацетоуксусного эфира предшествовало разрешение его для ряда более сложных случаев кето-енольной таутомерии, как, например, для диацетилянтарного эфира, для которого были найдены три следующие таутомерные формы:
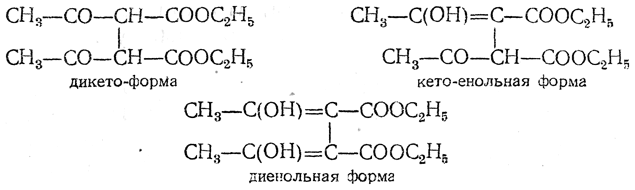
Здесь, как и в большинстве аналогичных случаев, возможно существование ряда стереоизомерных форм.
Для диацетилянтарного эфира и для многих других соединений таутомерные формы существуют при обычной температуре в твердом виде. Кроме того, в некоторых случаях таутомерное превращение различных форм друг в друга идет гораздо медленнее, чем у ацетоуксусного эфира. Эти обстоятельства чрезвычайно облегчили получение в чистом виде отдельных форм и изучение их взаимных превращений.
Исследования показали, что в большинстве случаев температура сравнительно мало влияет на положение равновесия. Однако в свежеперегнанном ацетоуксусном эфире часто находится много енольной формы. Это явление получило объяснение, когда было показано, что щелочь из стекла оказывает сильное каталитическое влияние на взаимные превращения двух форм. Именно поэтому при медленной перегонке из стеклянной колбы можно почти нацело превратить обыкновенный ацетоуксусный эфир в более низкокипящую енольную форму Наоборот, при проведении перегонки из кварцевой посуды, не оказывающей каталитического влияния на это превращение, в первых порциях отгоняется весь енол, а затем уже перегоняется чистый ацетоуксусный эфир,
Кроме того, оказалось, что на положение равновесия довольно сильно влияют растворители. Электролитически диссоциирующие растворители благоприятствуют образованию кетонной формы («кетизируют»), а неполярные растворители благоприятствуют образованию енольной формы («енолизируют»). Это видно из следующих данных о содержании енольной формы ацетоуксусного эфира в разных растворителях (вычислены по присоединению брома при 18° С к растворенному ацетоуксусному эфиру после установления равновесия между обеими формами):

Выше уже указывалось, что енольная группировка примерно на 22 ккал/моль энергетически менее выгодна, чем таутомерная ей группировка с карбонильной группой. Однако если двойная связь енольной группировки образует с имеющимися в молекуле другими двойными связями (>С=С< или >С=O) сопряженную систему, то может оказаться, что затрата энергии на енолизацию полностью или частично будет компенсироваться уменьшением энергии за счет образования системы сопряженных связей. Например, в случае ацетилацетона
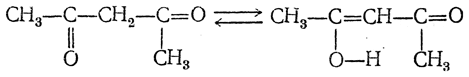
енольная форма реально существует, причем дополнительная стабилизация енола может достигаться вследствие возникновения, водородной связи
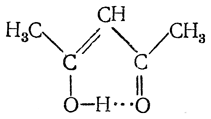
так как здесь расстояния О—Н∙∙∙О в точности отвечают соответствующим расстояниям в «димерах» карбоновых кислот.
Здесь следует обратить внимание на то, что енольная форма содержит группировку, являющуюся винилогом карбоксильной группы:
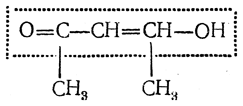
Поэтому можно было бы ожидать у оксикротонового эфира проявления кислотных свойств. На самом деле они очень слабы. Это объясняется связыванием атома водорода водородной связью, затрудняющей его протонизацию. Наоборот, сходные соединения, у которых водородная связь между гидроксильным атомом водорода и карбонильной группой невозможна по пространственным причинам, ведут себя, как карбоновые кислоты (см., например, димедон).


