Аквакомплексы
АКВАКОМПЛЕКСЫ, координац. соед., содержащие в кач-ве лигандов одну или неск. молекул воды. Последняя связана с центр, атомом металла через атом кислорода. Различают аквакомплексы катионного типа (напр., [Со(Н2О)6]С12), анионного (напр., К[Сг(Н2О)2(ОН)4]) и комплексы-неэлектролиты (напр., [PtCl4(H20)2]).
Аквакомплексы во мн. случаях легко образуются в водных р-рах из др. координац. соед. в результате внутрисферного замещения, гидратации катионов, а также присоединения молекул Н2О. В последнем случае координац. число центр. атома может повыситься, напр. в результате присоединения к анионам [АиС14]- или [PtCl4]- двух молекул воды.
В лабильных аквакомплексах аквагруппы вступают в р-ции обмена с высокой скоростью. Так, время практически полного изотопного обмена Н2О на 18Н2О в [А1(Н2О)6]3+ , [Fe(H2O)6]3+ и др. составляет при 25°С ок. 1 мин. Для стабильных аквакомплексов, напр. [Сг(Н2О)6]С13, время полупревращения при изотопном обмене - ок. 40 ч при 25°С.
Аквакомплексы обладают кислотными св-вами, напр.: [А1(Н20)6]3+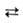 [А1(Н20)5ОН]2+ + Н +
[А1(Н20)5ОН]2+ + Н +
Для [Rh(NH3)5H2O]3+ pK кислотной диссоциации 5,86, для [Со(NН3)Н2O]3+ -5,69, для [Pt(NH3)5H2O]4+ -4,00.
Литература
Д ракин С. И., Шпакова С. Г., Дель Пино X., в кн.: Физика молекул, в. 2, К., 1976, с. 75-90. Н. Н. Желиговская.

Дополнения к описанию аквакомплексов: