Внутрикомплексные соединения
Внутрикомплексные соединения, клешневидные соединения, хелатные соединения, один из классов комплексных соединений. Классический пример внутрикомплексного соединения — гликоколят меди
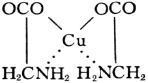
Адденд (радикал гликокола строения NH2CH2COO—) присоединяется к центральному атому (Cu) одновременно двумя функциональными группами. Связь Cu — O ионная, связь Cu — N ковалентная. Центральный атом (Cu) оказывается как бы втянутым внутрь адденда; отсюда и название соединений такого типа. Внутрикомплексные соединения характеризуются малой растворимостью в воде, аномальными окрасками, сильно различающимися для различных ионов металлов, что обеспечило им широкое применение в аналитической химии в качестве высокочувствительных и селективных реактивов. Хорошо известен специальный объёмный метод аналитической химии — комплексонометрия, — основанный на образовании внутрикомплексных соединений различных металлов с многоосновными аминокислотами, в частности с трилоном Б (динатриевой солью этилендиаминтетрауксусной кислоты). Важнейшие природные пигменты — хлорофилл и гемоглобин, являются внутрикомплексными соединениями.
Лит.: Гринберг А. А., Введение в химию комплексных соединений, 3 изд., М. — Л., 1966: Шварценбах Г., Комплексометрическое титрование, в кн.: Комплексометрия, М., 1958; Басоло Ф., Джонсон Р., Химия координационных соединений, пер. с англ., М., 1966.
Т. Н. Леонова.

Дополнения к описанию: