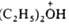Оксониевые соединения
ОКСОНИЕВЫЕ СОЕДИНЕНИЯ (оксониевые соли, соли оксония), содержат положительно заряженный атом кислорода, связанный ковалентно с орг. остатками и(или) водородом и ионной связью с анионом.
Простейшие неорганические оксониевые соединения-соли гидроксония [Н3О] + Х-, существующие обычно только в р-рах к-т; в кристаллич. состоянии получены лишь соед. с анионами , 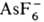 (т. разл. 193°С) и
(т. разл. 193°С) и 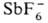 (т. разл. 357 °С).
(т. разл. 357 °С).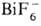
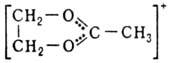
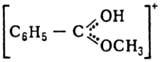
Органические оксониевые соединения в зависимости от числа орг. остатков у атома О подразделяют на первичные, вторичные и третичные. Наиб. устойчивы и больше всего изучены третичные оксониевые соединения. Известны след, типы третичных оксониевых соединений: [R3O]+X-, где R-алкил или арил; карбоксониевые (алкоксикарбониевые) соли - производные карбонильных соед. (напр., соед. ф-л I или II) и диалкилацилоксониевые соли (напр., III):
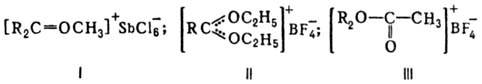
Карбоксониевые соед. м. б. представлены резонансом структур, напр.: 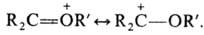 К оксониевым соединениям относят также пирилия соли с оксониевым атомом кислорода в 6-членном ароматич. цикле и "оксановые" соед., в к-рых оксониевый атом кислорода соединен ковалентно с тремя атомами металла и ионной связью с анионом, напр. [(ClHg)3O]+Cl-или [(Ph3PAu)3O] + BF-4 .
К оксониевым соединениям относят также пирилия соли с оксониевым атомом кислорода в 6-членном ароматич. цикле и "оксановые" соед., в к-рых оксониевый атом кислорода соединен ковалентно с тремя атомами металла и ионной связью с анионом, напр. [(ClHg)3O]+Cl-или [(Ph3PAu)3O] + BF-4 .
ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ ОКСОНИЕВЫХ СОЕДИНЕНИЙ, °С
| Анион | |||
| SbCl-6 | BF-4 | FeCl-4 | |
| (СН3)3О+ | 156-158 | 141 | 81 |
| (С2Н5)3O+ | 131 | 92 | 74 |
| (С6Н5)3O+* | - | 226 | - |
| | 149 | - | 53 |
| [С6Н5СН= OCH3]+ | 166 | - | (с разл.) |
| | 121-123 | 164-166 | - |
| [(СН3O)2С = ОСН3]+ | 130-131 | 138 | - |
| [С2Н5СН=ОН]+ | 181 | - | - |
| | 112-114 | - | - |
* Т.пл. [(С6Н5)3O]+Вг- 182°С, [(С6Н5)3О]+I- 177-178°C.
Свойства. Оксониевые соединения -кристаллич. солеобразные в-ва (см. табл.), раств. в полярных р-рителях (ацетон, CH3CN, CH3NO2, C6H5NO2, жидкий SO2), не раств. в диэтиловом эфире и углеводородах. Р-ры оксониевых соединений в воде электропроводны, по элект-рич. проводимости [(CH3)3O] + BF-4 близок к KI.
Алифатические и ароматические оксониевые соединения различаются геометрией молекул. Катион [(С2Н5)3О]+ имеет строение тригон. пирамиды с атомом О в вершине, расстояние между к-рым и плоскостью связанных с ним атомов углерода 0,0413 нм. В спектрах ПМР алифатических и ароматических оксониевых соединений наблюдается сдвиг сигналов соотв. 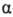 -Н-атома и орто-Н-атома в слабое поле примерно на 1 м. д. по сравнению с соответствующими простыми эфирами.
-Н-атома и орто-Н-атома в слабое поле примерно на 1 м. д. по сравнению с соответствующими простыми эфирами.
Алифатические оксониевые соединения устойчивы только при наличии комплексных анионов, обладающих слабыми нуклеоф. св-вами (ВF-4, РF-6 , 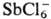 и т. п.), и легко разрушаются водой и спиртами. Особенно лабильны первичные и вторичные оксониевые соединения, быстро гидролизующиеся уже влагой воздуха; для третичных оксониевых соединений устойчивость в сильной степени зависит от природы аниона и уменьшается в ряду:
и т. п.), и легко разрушаются водой и спиртами. Особенно лабильны первичные и вторичные оксониевые соединения, быстро гидролизующиеся уже влагой воздуха; для третичных оксониевых соединений устойчивость в сильной степени зависит от природы аниона и уменьшается в ряду: 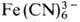
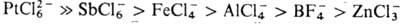 . Ароматич. третичные оксониевые соединения очень устойчивы и химически довольно инертны, они не реагируют с водой и разлагаются лишь при сильном нагревании:
. Ароматич. третичные оксониевые соединения очень устойчивы и химически довольно инертны, они не реагируют с водой и разлагаются лишь при сильном нагревании:
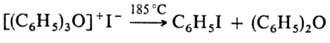
Третичные алифатические оксониевые соединения-одни из самых сильных алкилирующих агентов, в очень мягких условиях легко алкилируют не только спирты, фенолы, орг. к-ты, амины, сульфиды, но и соед., не алкилирующиеся обычными реагентами (AlkHal, Alk2SO4), напр, амиды к-т, сложные эфиры, кетоны, сульфоксиды, тиофен (по атому серы):
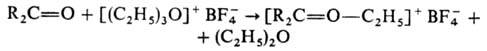
С помощью третичных алифатических оксониевых соединений синтезированы чрезвычайно реакционноспособные ацетали амидов к-т и лактамов, нитрилиевые соли (последние м. б. восстановлены до вторичных аминов) и эфиры нитроновых к-т, напр.:
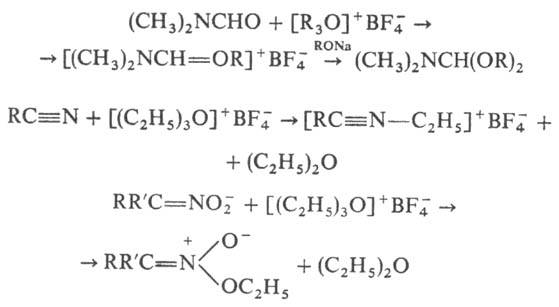
Карбоксониевые соед. могут реагировать с нуклеофилами по атому О или по атому С, напр.:
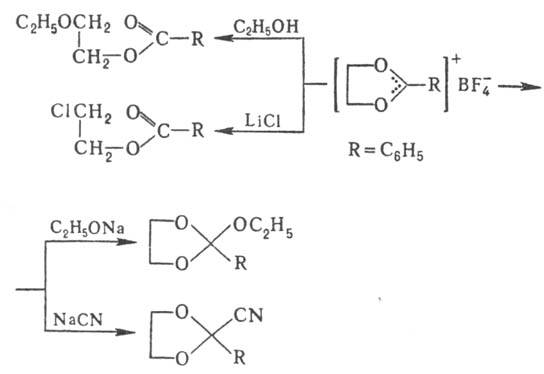
Оксониевые соединения могут использоваться для замены анионов в ониевых солях, напр.:
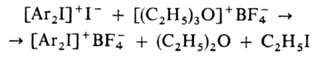
Соли трифенилоксония в отличие от своих алифатич. аналогов плохо реагируют с нуклеофилами:
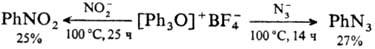
Они также трудно вступают в р-ции электроф. замещения; при этом в отличие от др. ароматич. ониевых соед. (см., напр., Галогенониевые соединения)замещение протекает в пара-положение, напр.:
Получение и применение. Общие способы получения третичных оксониевых соединений 1) Действием алкилгалогенидов на эфираты BF3 или SbCl5:
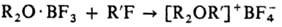
2) Взаимод. простых эфиров с алкилгалогенидами в присут, безводного AgBF4:
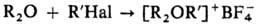
3) Алкилированием гидроксониевых солей или первичных и вторичных оксониевых соединений диазометаном, напр.:
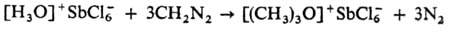
Борофторид триэтилоксония получают след, образом:
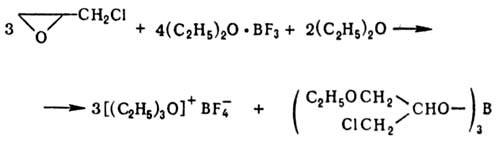
Третичные карбоксониевые соли получают: алкилирова-нием карбонильных соед. третичными оксониевыми соединениями или алкилгалогенидами в присут. безводного AgBF4, а также действием BF3 или SbCl5 на ортоэфиры:
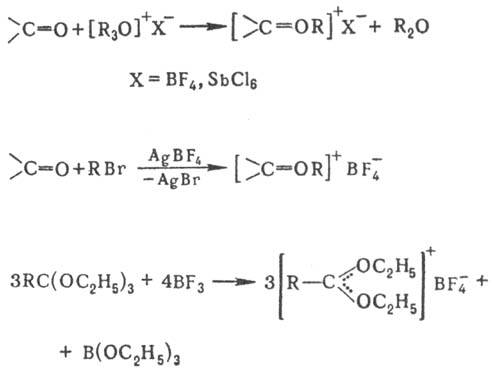
Первичные и вторичные оксониевые соединения получают взаимод. спиртов, простых эфиров или кетонов с комплексными к-тами [H4Fe(CN)6 , H3Fe(CN)6, H3Co(CN)6 , H2PtCl6] или с гало-генидами металлов (SbCl5 , FeCl3 , AlCl3 , SnCl4, ZnCl2) и безводным НСl. Р-цию проводят при т-ре от -70 до - 80 °С при полном отсутствии влаги, напр.:
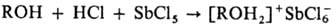
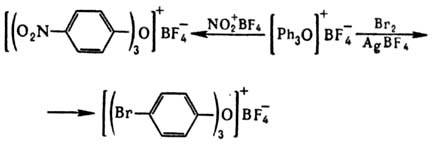
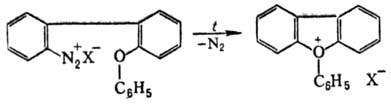
Ароматические оксониевые соединения получают термолизом борофторидов арилдиазония в дифениловом эфире или внутримол. циклизацией нек-рых диазосоед., напр.:
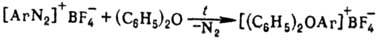
Оксониевые соединения применяют гл. обр. в качестве катализаторов катион-ной полимеризации и как алкилирующие агенты. Иногда их используют для активации инертных карбонильных групп и в качестве акцептора гидрид-иона.
Лит.: Несмеянов А. Н., Избр. труды, т. 2, М., 1959, с. 458-60, 467-72; т. 3, М., 1959, с. 325-65; Houben-Weyl, Methoden der organischen Chemie, 4 Aufl., Bd 6, Tl 3, Stuttg., 1965, S. 325-65; Perst H., Oxonium ions in organic chemistry, RY., 1971. Т.П. Толстая.