Глава 6. Растворы коллоидных поверхностно-активных веществ (лиофильные коллоидные системы)6.1. Общие представления
При рассмотрении поверхностных явлений, протекающих на поверхности раздела водного раствора с воздухом, мы выделили особую группу веществ, способных снижать поверхностное натяжение воды, и назвали их поверхностно-активными или сокращенно ПАВ. Все поверхностно-активные вещества содержат в своей молекуле группы атомов, резко различающиеся по своим свойствам. Углеводородные группы обладают сродством к неполярным жидкостям, собирательно называемым «масла», и антагонистичны по отношению к воде. Поэтому такие группы называют гидрофобными. Вместе с тем, молекулы ПАВ обязательно содержат группы, обеспечивающие их взаимодействие с молекулами воды и растворимость в ней. Такие группы называют гидрофильными. К ним относят гидроксильные, карбоксильные, сульфатные, сульфонатные, фосфатные, фосфонатные, оксиэтиленовые и многие разнообразные другие группы, содержащие атомы азота, серы, фосфора, кислорода. Гидрофобная часть молекул может состоять из линейной или разветвленной алифатической углеводородной цепи, или ароматического или нафталинового циклов, в которых один или два атома водорода замещены короткими углеводородными цепочками. В гидрофобной части молекул ПАВ атомы водорода частично или полностью могут быть замещены фтором или хлором, что повышает гидрофобность молекул и придает им особые свойства, вследствие чего такие вещества способны снижать поверхностное натяжение не только воды, но и многих углеводородных жидкостей. Подробная классификация ПАВ была приведена в главе 1 первой части курса.
Молекулы ПАВ в водном растворе могут распадаться на ионы и тогда такие вещества называют ионогенными. Если ПАВ содержит в молекуле полярные группы, диссоциирующие в водном растворе с образованием отрицательно заряженных длинноцепочечных органических ионов, определяющих его поверхностную активность, то такие вещества называют анионактивными. Если же при диссоциации ПАВ образуются длинноцепочечные катионы, то их называют катионоактивными. В том случае, если ПАВ растворяется в воде без образования ионов, а растворимость его определяется наличием в молекуле нескольких полярных групп, имеющих сильное сродство к воде, то такие вещества называют неионогенными (нПАВ). Существует особая группа ПАВ с несколькими полярными группами, которые в водном растворе (в зависимости от условий, в основном, от величины рН), могут быть ионизированы с образованием длинноцепочечных анионов или катионов, что придает им свойства анионных или катионных веществ, называемых амфотерными или амфолитными.
Для характеристики равновесия свойств, придаваемых молекулам ПАВ одновременным присутствием гидрофобных и гидрофильных групп, используют понятие гидрофильно-липофильного баланса (ГЛБ). ГЛБ выражают некоторым безразмерным числом, позволяющим оценивать относительную роль отдельных частей дифильной молекулы ПАВ (гидрофильных групп и неполярной углеводородной или фторуглеродной цепи) в проявлении сродства молекулы в целом к внешней среде – воде или органическим жидкостям.
Растворы поверхностно-активных веществ, содержащих в углеводородном радикале не менее 8 атомов углерода, при концентрациях, больших некоторой критической величины, приобретают свойства коллоидных систем.
Концентрацию ПАВ, при которой в его растворе возникает большое количество мицелл, находящихся в термодинамическом равновесии с молекулами (ионами), и резко изменяется ряд свойств раствора, называют критической концентрацией мицеллообразования (ККМ). Мицеллами ПАВ называют агрегат из длинноцепочечных дифильных молекул или ионов, образующихся самопроизвольно в их растворах выше ККМ, зависящей от природы полярной группы (групп) и особенно от длины цепи молекулы. В водных растворах ассоциация части молекул (ионов) происходит в результате сцепления цепей, в неводных (неполярных) средах – за счет сцепления полярных групп.
Агрегация молекул и образование мицелл в растворах этих веществ происходит самопроизвольно с уменьшением свободной энергии системы. Образовавшиеся системы имеют высокую степень дисперсности и термодинамически равновесны и устойчивы.
Одной из основных характеристик ПАВ является способность снижать поверхностное натяжение (s) воды – поверхностная активность (G),
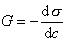 , (2.6.1)
, (2.6.1)
где с – концентрация раствора.
Эти вещества всегда поверхностно-активны на границе раздела «воздух – вода» и «вода – углеводород (масло)». Однако они часто оказываются активными и на поверхности «твердое тело-раствор». Как правило, поверхностная активность в основном определяется длиной углеводородного радикала, т.е. гидрофобностью данного ПАВ.
Между поверхностными и объемными свойствами растворов ПАВ существует самая тесная связь. Например, как показал Ребиндер поверхностную активность можно рассматривать как предельное понижение поверхностного натяжения, отнесенное к критической концентрации мицеллообразования:
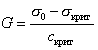 , (2.6.2)
, (2.6.2)
где sкрит–наименьшее значение поверхностного натяжения, наблюдаемое, как правило, после достижения критической концентрации мицеллообразования скрит.
Предельное понижение поверхностного натяжения (s0-sкрит) для различных ПАВ имеет примерно постоянную величину, так как sk»(25¸30 мДж/м2), поэтому
Ds = (s0 - sкрит) » (73 – 28) = 24 мДж/м2 . (2.6.3)
Такое понижение связано с образованием адсорбционного слоя ПАВ, ориентированного углеводородными радикалами в газовую фазу с образованием двумерной углеводородной пленки, для которой sкрит »(25¸30) мДж/м2.
Но значения ККМ для различных ПАВ могут иметь величины, отличающиеся на 2-3 порядка. Таким образом, очевидно, что поверхностная активность, рассчитанная по уравнению (2.6.2), целиком определяется объемными свойствами растворов ПАВ.
Оценка поверхностной активности по критической концентрации мицеллообразования имеет огромное экономическое значение, определяя минимальный расход ПАВ, необходимый для наиболее эффективного их действия в различных технологических процессах.
Как правило, найденная каким-либо методом критическая концентрация мицеллообразования – это некоторая средняя концентрация той концентрационной области, в которой происходит переход из молекулярного состояния растворенного вещества к мицеллярному. При этом образуется высокодисперсная система, состоящая из двух фаз.
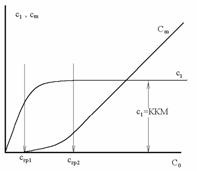
Переход из одного состояния системы в другое происходит в достаточно узкой концентрационной области, причем многие свойства растворов претерпевают явно выраженные, подчас скачкообразные, изменения. Изменение концентрации единичных (неассоциированных) с1 и ассоциированных сm молекул в зависимости от общей концентрации раствора с0 приведена на рис. 2.53.
Рис. 2.53. Зависимость концентрации неассоциированных молекул (с1) и мицелл (сm) от общей концентрации ПАВ |
Концентрация единичных (неассоциированных) молекул в зависимости от общей концентрации раствора увеличивается линейно вплоть до первой граничной концентрации сгр1, при которой начинается образование мелких предассоциатов, содержащих 3-5 молекул (ионов) ПАВ. Затем в достаточно узкой области концентраций происходит рост предассоциатов и при второй граничной концентрации сгр2 формирование мицелл завершается.
Считается, что после завершения формирования мицелл концентрация единичных (неассоциированных) молекул остается примерно постоянной, а все введенное сверх ККМ вещество переходит в мицеллы. Концентрацию мицелл сm можем рассчитать как
сm = (с0 – скрит)/ m , (2.6.4)
где m – среднее число агрегации мицелл, т.е. число молекул, ассоциированных в одной мицелле.