Протеиногенные аминокислоты А. Протеиногенные аминокислоты
Протеиногенными называются 20 аминокислот, которые кодируются генетическим кодом и включаются в белки в процессе трансляции. Строение боковых цепей этих аминокислот приведено на с. 67.
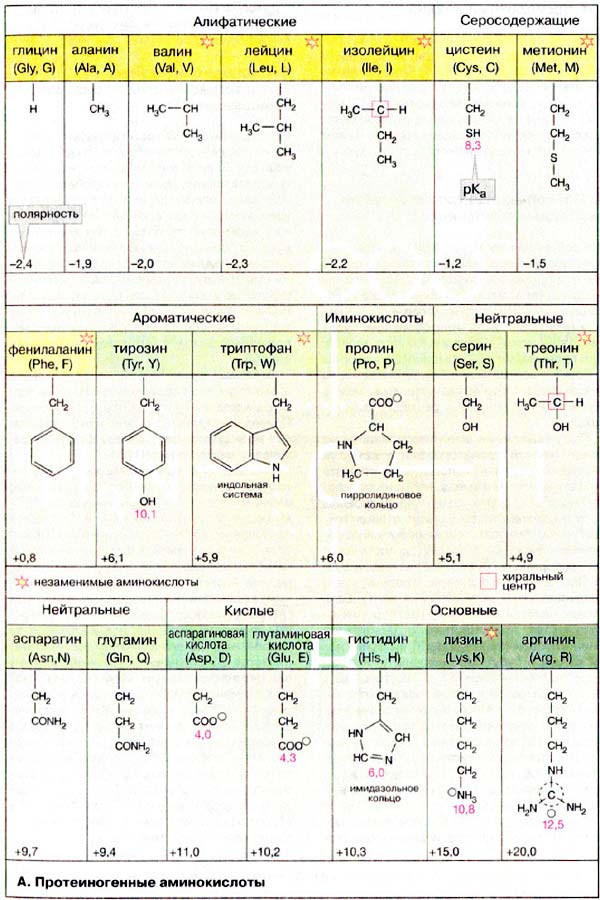
Классификация этих аминокислот основана как на строении, так и на полярности боковых цепей.
В таблице для каждой из аминокислот приводятся следующие характеристики:
— классификация (семь классов);
— название и принятое сокращение (по трем первым буквам) (например, для гистидина — Нis);
— однобуквенный символ, удобный при записи белковых последовательностей (для гистидина — Н);
— полярность боковой цепи (для гистидина +10,3): чем выше эта величина, тем более полярна молекула аминокислоты.
На схеме по мере увеличения полярности окраска поля с названием аминокислоты меняется от желтых тонов через зеленые к синим. Для ионогенных групп боковой цепи приведены рКa (цифры красного цвета).
К алифатическим аминокислотам относятся глицин, аланин, валин, лейцин и изолейцин. Эти аминокислоты не несут в боковой цепи гетероатомов (N, О или S), циклических группировок и характеризуются отчетливо выраженной низкой полярностью.
Также малополярны серосодержащие аминокислоты — метионин и цистеин, причем цистеин существует лишь в недиссоциированном состоянии. Благодаря образованию дисульфидных мостиков, цистеин выполняет важную функцию стабилизации пространственной структуры белков. Аминокислота цистин состоит из двух остатков цистеина, соединенных дисульфидным мостиком.
Ароматические аминокислоты содержат мезомерные (резонансно стабилизированные) циклы. В этой группе лишь фенилаланин проявляет низкую полярность. Тирозин и триптофан характеризуются заметной, а гистидин — даже высокой полярностью. Имидазольное кольцо гистидина заметно протонируется уже при слабокислых значениях рН. Поэтому гистидин, обладающий ароматическими свойствами лишь в протонированной форме, может быть отнесен к основным аминокислотам. Тирозин и триптофан сильно поглощают в УФ-области спектра между 250 и 300 нм.
Нейтральные аминокислоты содержат гидроксильные (серин, треонин) или карбоксамидные группы (аспарагин, глутамин). Хотя амидные группы неионогенны, молекулы аспарагина и глутамина высоко полярны.
Карбоксильные группы боковых цепей кислых аминокислот — аспарагиновой и глутаминовой — полностью ионизированы во всем диапазоне физиологических значений рН. Аналогичным образом, боковые цепи основных аминокислот — лизина и аргинина — полностью протонированы в нейтральной области рН. Сильно основной, а, следовательно, очень полярной аминокислотой, является аргинин, содержащий гуанидиновую группировку.
Особое положение занимает пролин. Боковая цепь пролина состоит из пятичленного цикла, включающего α-углеродный атом и α-аминогруппу. Поэтому пролин, строго говоря, является не амино-, а иминокислотой. Атом азота и кольце является слабым основанием и не протонируется при физиологических значениях рН. Благодаря циклической структуре пролин вызывает изгибы полипептидной цепи, что очень существенно для структуры коллагена (см. сс. 76, 334).
Некоторые из перечисленных аминокислот не могут синтезироваться в организме человека и должны поступать вместе с пищей. Эти незаменимые аминокислоты отмечены звездочками красного цвета.


