4.2. Поверхностные явления. Адсорбция
19. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ- явления, происходящие на поверхности раздела соприкасающихся фаз и характеризующиеся особыми свойствами межфазных поверхностных слоев.
20. ПОВЕРХНОСТНЫЙ СЛОЙ- неоднородный тонкий слой определенной толщины и объема, который располагается по обе стороны поверхности, разделяющей две соприкасающиеся объемные фазы.
21. ПОВЕРХНОСТНАЯ ЭНЕРГИЯ - избыток энергии на границе раздела двух фаз, связанный с существованием поверхностного слоя.
22. СВОБОДНАЯ ПОВЕРХНОСТНАЯ ЭНЕРГИЯ - избыток свободной энергии, содержащейся в поверхностном слое на границе раздела двух соприкасающихся фаз (Ж-Г, Ж-Ж, Ж-Т) по сравнению с энергией объемной части этих фаз. Удельная поверхностная энергия относится к единице поверхности и измеряется работой изотермического и обратимого образования единицы поверхностного слоя; выражается в Дж/м2.
23. ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ - сила, отнесенная к единице длины периметра поверхностного слоя. Для жидкости оно численно равно свободной поверхностной энергии и выражается в Н/м или Дж/м2.
24. ПОВЕРХНОСТНО-АКТИВНОЕ ВЕЩЕСТВО – такое вещество, которое способно адсорбироваться на поверхности раздела фаз, снижая избыток поверхностной энергии.
К типичным ПАВ относятся органические соединения, молекулы которых имеют дифильный характер.
Вещество, поверхностно-активное на одной границе раздела, на другой границе раздела может быть инактивным (не способным к адсорбции).
Адсорбируясь на межфазных поверхностях раздела, ПАВ образуют на них моно- или полимолекулярные слои ориентированных молекул, резко изменяя молекулярную природу поверхности.
26. НЕПОЛЯРНАЯ (ГИДРОФОБНАЯ ИЛИ ЛИПОФИЛЬНАЯ) ГРУППА - часть молекулы ПАВ (обычно в виде углеводородной цепи) без заметного дипольного момента, придающая молекуле гидрофобность или липофильность, т.е. сродство к малополярным средам.
27. СМАЧИВАНИЕ - явление, возникающее на трехфазной границе раздела при соприкосновении жидкости с поверхностью твердого тела; оно проявляется в полном или частичном растекании жидкости по поверхности вследствие сильного межмолекулярного взаимодействия поверхности и жидкости. Смачивание характеризуется величиной краевого угла, или угла смачивания.
28. КРАЕВОЙ УГОЛ СМАЧИВАНИЯ - угол между поверхностями твердого тела и смачивающей жидкости по периметру соприкосновения трех фаз: твердое тело-жидкость-газ (пар) или твердое тело-жидкость-жидкость (в плоскости, перпендикулярной к линии контакта). Количественной характеристикой смачивающей способности жидкости служит косинус краевого угла смачивания.
29. ГИСТЕРЕЗИС СМАЧИВАНИЯ - явление задержки в установлении равновесного угла смачивания. Различают два вида гистерезиса смачивания: кинетический, измеряемый разностью величин краевых углов натекания (он всегда больше равновесного) и отекания (он всегда меньше равновесного), статический, определяемый как разность равновесного значения краевого угла на данной поверхности и его реально измеренного значения (в статических условиях, без перемещения жидкости по поверхности). Статический гистерезис является результатом снижения подвижности периметра смачивания, вызываемого особенностями молекулярной природы поверхности.
30. КОЭФФИЦИЕНТ РАСТЕКАНИЯ - уменьшение при растекании жидкости свободной поверхностной энергии на границе раздела твердое тело-жидкость, выражается в Н/м. Если величина коэффициента положительна жидкость самопроизвольно растекается в тонкую пленку.
31. СВОБОДНАЯ ЭНЕРГИЯ СМАЧИВАНИЯ - изменение свободной энергии при смачивании твердого тела. Жидкость растекается и смачивает поверхность, если при этом свободная энергия системы уменьшается.
32. СМАЧИВАЮЩАЯ СПОСОБНОСТЬ - способность жидкости смачивать твердую поверхность или растекаться по ней.
33. СМАЧИВАТЕЛИ - растворимые поверхностно-активные вещества, понижающие поверхностное натяжение на границах раздела Т-Ж и Ж-Г.
При нанесении смачивателя на поверхность краевой угол уменьшается в результате снижения межфазового натяжения sж/т и sж/г, и смачивающая способность жидкости улучшается.
34. ПОВЕРХНОСТНАЯ АКТИВНОСТЬ - способность вещества понижать свободную поверхностную энергию (поверхностное натяжение) в результате адсорбции на границе раздела фаз. Величина 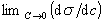 - мера поверхностной активности данного вещества. Обозначается буквой G.
- мера поверхностной активности данного вещества. Обозначается буквой G.
35. ПРАВИЛО ТРАУБЕ - в гомологическом ряду ПАВ поверхностная активность вещества увеличивается в 3-3,5 раза при удлинении углеводородной цепи на одно звено (группу-CH2-).
36. ПРАВИЛО АНТОНОВА - межфазовое натяжение на границе двух несмешивающихся жидкостей равно разности поверхностных натяжений этих жидкостей (на границе с воздухом или собственным паром) в условиях взаимного насыщения: 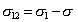 .
.
36. ФЛОТАЦИЯ - процесс разделения смеси порошков на основе их избирательного смачивания жидкостями. В настоящее время широкое применение получила пенная флотация. Она заключается в том, что в суспензию минерала вводят пузырьки воздуха, к которым прилипают гидрофобные частицы руды. На поверхности образуется минерализованная пена, которая удаляется в виде концентрата руды. Хорошо смачиваемые водой частицы пустой породы не прилипают к пузырькам, оседают на дно и образуют отходы флотации.
38. ФЛОТОАГЕНТЫ - поверхностно-активные вещества с дифильной структурой, которые вводятся для увеличения различия в гидрофобности поверхности частиц ценного минерала и пустой породы. При избирательной адсорбции ПАВ поверхность частиц минерала гидрофобизируется и флотационный процесс протекает интенсивнее. В качестве флотоагентов часто используют жирные кислоты и их соли.
39. АДСОРБЦИЯ - процесс перехода растворенного вещества или газа из объемной фазы в поверхностный слой, связанный с изменением свободной поверхностной энергии слоя. Величина адсорбции определяет избыток массы (молекул) адсорбированного вещества на единицу поверхности слоя по сравнению с объемом.
40. ХЕМОСОРБЦИЯ - необратимый процесс адсорбции, осуществляемый за счет химических сил. Теплота химической адсорбции соизмерима с теплотой химической реакции.
41. АДСОРБЕНТ - жидкость или твердое тело, способное сгущать на своей поверхности газ или растворенное вещество, т.е. осуществлять адсорбцию.
42. АДСОРБАТ - адсорбционный комплекс, образованный адсорбтивом и адсорбентом. По своим свойствам отличается от свойств исходных компонентов.
43. АДСОРБТИВ - газ или растворенное вещество, способные адсорбироваться на поверхности жидкости или твердого тела.
44. АДСОРБЦИОННЫЙ СЛОЙ - слой, образованный на поверхности раздела адсорбента на границе с другой средой (газом, жидкостью или твердым телом), состоящей из адсорбированных молекул, и характеризующийся повышенной концентрацией по сравнению с их концентрацией в объемах обеих фаз.
45. МОНОМОЛЕКУЛЯРНЫЙ СЛОЙ - адсорбционный слой на поверхности адсорбента, толщиной в одну молекулу. При адсорбции ПАВ толщина слоя определяется длиной ориентированной молекулы.
46. ПЛЕНКА - тонкий слой (обычно жидкости, иногда вещества в твердообразном состоянии), значительно более толстый по сравнению с поверхностным слоем, который должен рассматриваться как отдельная фаза.
47. ПОВЕРХНОСТНАЯ ПЛЕНКА - такой поверхностный слой, отдельные компоненты которого (или хотя бы один из них) отсутствуют в объемных фазах. Наиболее распространены пленки нерастворимых веществ на поверхности воды и водных растворов. В случае дифильных молекул происходит растекание жидкости и образование мономолекулярного слоя.
Мономолекулярные пленки на поверхности воды могут находиться в трех двухмерных состояниях: газообразном, жидком и твердом.
Жидкие и твердые пленки называют конденсированными. Если силы, действующие между молекулами в пленке, сравнительно невелики, то молекулы ПАВ стремятся удалиться друг от друга на возможно большие расстояния. Такую пленку называют газообразной.
Газообразные пленки характерны для дифильных молекул с числом углеродных атомов в цепи 12-20.
При относительно длинных углеводородных радикалах дифильных молекул, содержащих более 20-24 атомов углерода, образуются конденсированные пленки вследствие сильного взаимодействия между углеводородными радикалами. Молекулы обычно ориентируются параллельно друг другу и перпендикулярно к поверхности воды, образуя своеобразный «частокол». При свободном перемещении молекул в пленках их можно считать жидкими. Если действующие между радикалами молекул силы настолько велики, что молекулы не могут перемещаться, то конденсированные пленки можно рассматривать как твердые.
48. АДГЕЗИЯ – явление, близкое к явлениям адсорбции и смачивания, когда две взаимно нерастворимые жидкости, либо жидкость и твердое тело, либо два твердых тела приводятся в тесный контакт друг с другом и под действием межмолекулярных или иных (например, электрических) сил прочно прилипают друг к другу так, что для их разделения надо приложить известное усилие, т.е. произвести работу.
49. ПРАВИЛО УРАВНИВАНИЯ ПОЛЯРНОСТЕЙ РЕБИНДЕРА - процесс адсорбции идет в сторону выравнивания полярностей фаз и тем сильнее, чем больше первоначальная разность полярностей.
Тенденция системы к уменьшению поверхностного натяжения, обусловленного разностью полярностей двух фаз, определяет ориентацию молекул ПАВ в поверхностном слое.
Полярные группы ПАВ обычно ориентированы к полярной фазе, а углеводородные радикалы - к неполярной.
50. ГИДРОФИЛИЗАЦИЯ - явление, связанное с ориентированной адсорбцией дифильных веществ, в результате чего гидрофобная поверхность приобретает гидрофильные свойства.
51. ЛИОФИЛЬНОСТЬ, ЛИОФОБНОСТЬ (КРИТЕРИЙ ЛИОФИЛЬНОСТИ РЕБИНДЕРА) - классификация лиозолей на лиофильные и лиофобные основана на величине удельной свободной межфазовой энергии. В качестве критерия используется предельное значение межфазного натяжения при температуре 25о С равное 0,1 мДж/м2. Системы, имеющие большее значение межфазного натяжения, относятся к лиофобным, меньшее - к лиофильным.
Лиофобные системы требуют для своего существования введения стабилизатора. Лиофильные, как правило, образуются самопроизвольно и устойчивы без введения стабилизаторов.
52. АДСОРБЦИОННОЕ ПОНИЖЕНИЕ ПРОЧНОСТИ – явление, связанное с развитием микродефектов структуры твердого тела при адсорбции молекул поверхностно-активных веществ или электролитов. В результате нелокализованной адсорбции молекулы или ионы стремятся раздвинуть микрощели и способствуют этим диспергированию под действием внешних деформирующих сил. Облегчение диспергирования под влиянием адсорбции получило название эффекта Ребиндера.
53. КАПИЛЛЯРНАЯ КОНДЕНСАЦИЯ - конденсация паров при давлениях, значительно отличающихся от давления насыщения, связанная с образованием вогнутых менисков жидкости в порах (капиллярах) адсорбента.
54. КАПИЛЛЯРНЫЙ ГИСТЕРЕЗИС - явление, связанное с наложением капиллярной конденсации на процесс адсорбции на пористых адсорбентах. При адсорбции, сопровождающейся капиллярной конденсацией, изотермы адсорбции и десорбции не совпадают. Истинному (равновесному) процессу адсорбции соответствует десорбционная ветвь на изотерме.
55. ОБРАЩЕНИЕ ПРАВИЛА ТРАУБЕ - явления, имеющие место в тонкопористых адсорбентах и в растворах неполярных растворителей, состоящие в уменьшении адсорбции с ростом длины молекулы адсорбата выше определенного критического значения.
56. ИОНООБМЕННАЯ АДСОРБЦИЯ - адсорбция ионов из раствора, сопровождающаяся выделением эквивалентного количества ионов из адсорбента.
Наиболее распространенными адсорбентами при ионообменной адсорбции являются смолы, способные обменивать ионы гидроксила или водорода.
57. ИОНООБМЕННЫЕ СМОЛЫ – синтетические иониты, полученные путем полимеризации или поликонденсации иономеров, содержащих активные группы, способные обмениваться ионами с раствором. Активные группы могут также вводится в готовый полимер. Способность смол к обмену ионами характеризуется обменной емкостью, которая выражается числом мг/экв. ионов на один грамм смолы. После насыщения ионит обычно регенерируют. Для этого катиониты обрабатывают кислотой, а аниониты - растворами щелочей.
58. ХРОМАТОГРАФИЯ - метод анализа и разделения многокомпонентных смесей в результате сорбционных процессов при направленном движении одной из фаз.


