Структурные белки
Структурные белки придают экстрацеллюлярным структурам механическую прочность, а также участвуют в построении цитоскелета. В большинстве структурных белков преобладает одна из вторичных структур, что предопределяется их аминокислотным составом.
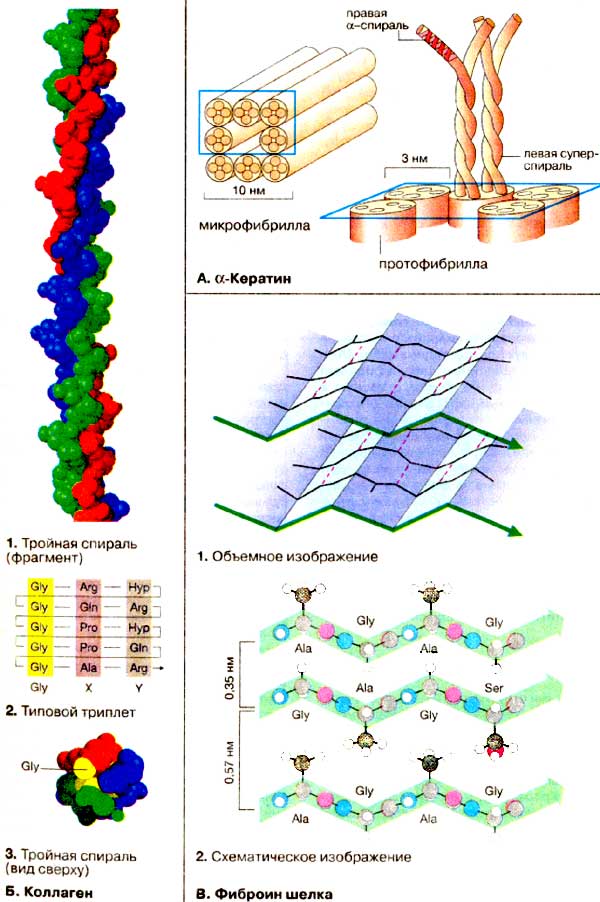
А. α-Кератин
Структурным белком, построенным преимущественно в виде α-спирали, является α-кератин. Волосы (шерсть), перья, иглы, когти и копыта животных состоят главным образом из кератина. В качестве компонента промежуточных филаментов кератин (цитокератин) является важнейшей составной частью цитоскелета.
В кератинах большая часть пептидной цепи свернута в правую α-спираль. Две пептидные цепи образуют единую левую суперспираль, как это имеет место и в миозине. Суперспирализованные димеры кератина объединяются в тетрамеры, которые агрегируют с образованием протофибрилл диаметром 3 нм. Наконец, восемь протофибрилл образуют микрофибриллы диаметром 10 нм.
Волосы построены из таких же фибрилл. Так, в отдельном волокне шерсти диаметром 20 мкм переплетены миллионы фибрилл. Отдельные цепи кератина скреплены поперечно многочисленными дисульфидными связями, что придает им дополнительную прочность. При химической завивке происходят следующие процессы: вначале путем восстановления тиолами разрушаются дисульфидные мостики, а затем для придания волосам необходимой формы их высушивают при нагревании. При этом за счет окисления кислородом воздуха образуются новые дисульфидные мостики, которые сохраняют форму прически.
Б. Коллаген
В организме млекопитающих коллаген — преобладающий в количественном отношении белок: он составляет 25% общего белка. Коллаген присутствует в различных формах прежде всего в соединительной ткани. Этот белок имеет необычный аминокислотный состав: 1/З составляв глицин (Gly). примерно 10% пролин (Рrо), а также гидроксипролин (Hyp) и гидроксилизин (Hyl). Последние две аминокислоты образуются после биосинтеза коллагена путем посттрансляционной модификации. В структуре коллагена постоянно повторяется триплет Gly-X-Y (2), причем положение X часто занимает пролин, а Y — гидроксилизин. Имеются веские основания тому, что коллаген повсеместно присутствует в виде правой тройной спирали, скрученной из трех первичных левых спиралей (1). В тройной спирали каждый третий остаток оказывается в центре, где по стерическим причинам помещается только глицин (3, остаток глицина окрашен в желтый цвет). Здесь представлен небольшой фрагмент тройной спирали. Вся молекула коллагена имеет длину около 300 нм.
В. Фиброин шелка
Шелк получают из коконов гусениц тутового шелкопряда (Воmbух mori) и родственных видов. Ocновной белок шелка, фиброин, обладает структурой антипараллельного складчатого листа, причем сами листы располагаются параллельно друг другу, образуя многочисленные пласты (1). Так как в складчатых структурах боковые цепи аминокислотных остатков ориентированы вертикально вверх и вниз, в промежутках между отдельными слоями могут поместиться лишь компактные группировки. Фактически фиброин состоит на 80% из глицина, аланина и серина, т.е. из трех аминокислот, характеризующихся минимальными размерами боковых цепей. Молекула фиброина содержит типичный повторяющийся фрагмент (Gly-Ala-GIy-AIa-GIy-Ser)n . Установлено, что в фиброине промежуток между складчатыми слоями составляет 0,35 и 0,57 нм. В первом случае в промежуток ориентирован глицин (R = H). Промежуток 0,57 нм создается за счет отталкивания боковых цепей серина и аланина (2).


