Вторичные структуры белков
Определенные сочетания двугранных углов φ и ψ встречаются в белках довольно часто. Если множество последовательно связанных аминокислотных остатков принимает стандартные конформации, формируются вторичные структуры, стабилизированные водородными мостиками в пределах одной пептидной цепи или между соседними цепями. Если такая регулярная структура распространяется на достаточно большой фрагмент молекулы белка, такой белок образует механически прочные нити или волокна. Подобного рода структурные белки имеют характерный аминокислотный состав.
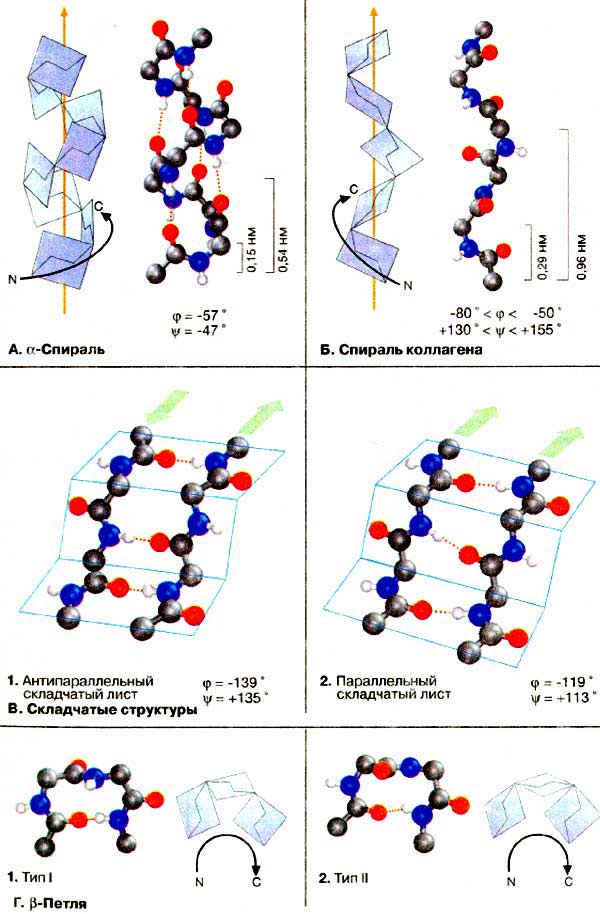
Здесь приведены основные элементы вторичных структур. На рисунках представлен остов полипептидной цепи, лишенный боковых цепей аминокислотных остатков. Для наглядности плоскости пептидных связей изображены в виде голубых пластин. Двугранные углы указанных структур приведены на конформационной карте Г1 на с. 73.
А. α-Спираль
Наиболее распространенным элементом вторичной структуры является правая α-спираль (αR). Пептидная цепь здесь изгибается винтообразно (ось выделена оранжевым цветом). Ha каждый виток приходится 3,6 аминокислотного остатка, шаг винта (т.е. минимальное расстояние между двумя эквивалентными точками) составляет 0,54 нм. α-Спираль стабилизирована почти линейными водородными связями (красный пунктир, см. с. 14) между NH-группой и СО-группой четвертого по счету аминокислотного остатка. Таким образом, в протяженных спиральных участках каждый аминокислотный остаток принимает участие в формировании двух водородных связей. Неполярные или амфифильные α-спирали с 5-6 витками часто обеспечивают заякоривание белков в биологических мембранах (трансмембранные спирали, см. сс. 135, 216).
Зеркально-симметричная относительно αR-спирали левая α-спираль (αL) встречается в природе крайне редко, хотя энергетически возможна.
Б. Спираль коллагена
Другая форма спирали присутствует в коллагене, важнейшем компоненте соединительных тканей (см. сс. 76, 334). Это левая спираль коллагена с шагом 0,96 нм и 3,3 остатка в каждом витке, более пологая по сравнению с α-спиралью, В отличие от α-спирали образование водородных мостиков здесь невозможно. Структура стабилизирована за счет скручивания трех пептидных цепей в правую тройную спираль.
В. Складчатые структуры
Две следующие почти вытянутые конформации пептидной цепи называются "β-складчатым листом", так как плоскости пептидных связей расположены в пространстве подобно равномерным складкам листа бумаги. B складчатых структурах также образуются поперечные межцепочечные водородные связи. Если цепи ориентированы в противоположных направлениях (1), структура называется антипараллельным складчатым листом (βα), а если цепи ориентированы в одном направлении (2), структура называется параллельным складчатым листом (βn). В складчатых структурах α-С-атомы располагаются на перегибах, а боковые цепи ориентированы почти перпендикулярно средней плоскости листа, попеременно вверх и вниз. Энергетически более предпочтительной оказывается βα-складчатая структура с почти линейными H-мостиками. В растянутых складчатых листах отдельные цепи чаще всего не параллельны, а несколько изогнуты относительно друг друга.
Г. β-Петля
В тех участках, где пептидная цепь изгибается достаточно круто, часто находится β-петля. Это короткий фрагмент, в котором 4 аминокислотных остатка расположены таким образом, что цепь делает реверсивный поворот (на 180о). Оба приведенных на схеме варианта петли (типы I и II) встречаются довольно часто. Обе структуры стабилизированы водородным мостиком между 1 и 4 остатками.


