МЕЖГАЛОГEННЫЕ СОЕДИНЕНИЯ,
соединения разл. галогенов между собой. Обычно имеют состав XYn,
где п = 1, 3, 5 или 7. Помимо галогенфторидов к ним относятся
BrCl, ICl, IBr, ВrСl3, IСl3 и Вr3Сl (см. табл.).
Наиб. устойчивы моногалогениды XY (кроме фторидов Вr и I). В жидкой фазе
межгалогенные соединения подвергаются частичной самоионизации. По хим. св-вам они близки к галогенам.
Раств. в воде с частичным или полным гидролизом, напр. по р-циям:
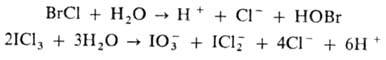
Раств. в р-рах хлоридов
металлов с образованием устойчивых полигалогенид-ионов:
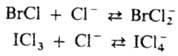
СВОЙСТВА МЕЖГАЛОГЕННЫХ
СОЕДИНЕНИЙ
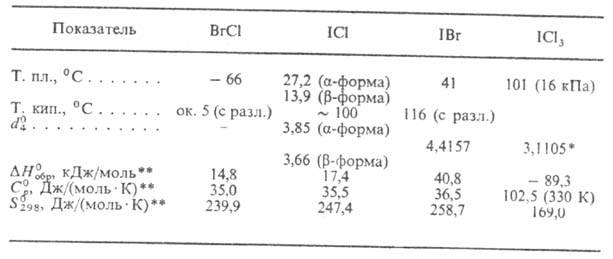
* d415.
** Для твердого в-ва в случае IСl3, для газа-в остальных случаях.
Раств. в орг. р-рителях.
Моногалогениды раств. в AsCl3, SO2, SOC12,
ледяной уксусной к-те.
Межгалогенные соединения могут быть донорами
или акцепторами галогенид-ионов. С галогенидами щелочных металлов образуют соли
с анионами BrCl-2, ICl-2, IBr-2,
ICl-4, I2Cl-3, напр.:
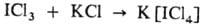
С к-тами Льюиса (АlСl3,
SbCl5 и др.) дают соли с катионами I2Сl+, IСl+2
и др., напр.:
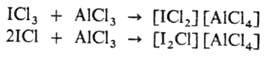
Известны также полигалогенид-ионы
Вr2Сl-, I2Вr-, IBrCl-,
IBrF-, ICl3F-, ICl-4
и др. См. также Полигалоге-ниды.
Получают межгалогенные соединения из элементов
при комнатной или более низкой т-ре, в р-рителях или без них. Тригалогениды
(кроме трифторидов) получают под давлением или в микроволновом разряде. Межгалогенные соединения
применяют в орг. синтезе.
Хлорид брома BrCl-желтый
газ; образуется как побочный продукт при получении Вr2 из прир. рассолов.
Хлорид иода ICl - кристаллы; существует в двух модификациях моноклинной сингонии
(пространств. группа P21 /c, z = 8). Для рубиново-красной
a-формы: а = 1,1260 нм, b = 0,438 нм, с = 1,190 нм, b =
119,5°; для красно-коричневой b-формы: а = 0,8883 нм, b = 0,8400
нм, с = 0,7568 нм, b = 91,35°. Реагент для определения йодного числа.
Бромид иода IBr - кристаллы
с ромбич. решеткой (а = 0,4903 нм, b = 0,6993 нм, с = 0,8931
нм, z = 4, пространств. группа Сст21 ). Трихлорид
иода IСl3-желтые кристаллы с триклинной решеткой (а = 0,571
нм, b= 1,088 нм, с = 0,548нм, a = 130,83°, b = 80,85°,
g = = 108,50°, z = 2); разлагается ок. 60 °С на ICl и Сl2.
Лит. см. при ст.
Галогены. Э. Г. Раков.
===
Исп. литература для статьи «МЕЖГАЛОГEННЫЕ СОЕДИНЕНИЯ»: нет данных
Страница «МЕЖГАЛОГEННЫЕ СОЕДИНЕНИЯ» подготовлена по материалам химической энциклопедии.