Индукционное взаимное влияние
Весьма важной и крайне интересной является проблема взаимного влияния атомов, непосредственно не связанных друг с другом, а разделенных системой простых связей. В таких системах взаимное влияние атомов осуществляется индукционным путем. Для того чтобы составить общее представление о характере такого влияния, сравним, например, следующие три системы:
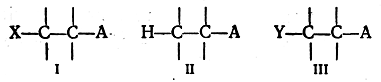
Если X — электроотрицательный атом или электроотрицательная группа атомов, то связь X—С поляризована так, что X является отрицательным концом диполя, а углерод — положительным. Так как углерод несет некоторый положительный заряд, то электронная пара, связывающая его с соседним атомом углерода, смещается по направлению к первому С-атому, что в свою очередь вызывает оттягивание электронной пары от атома (или группы атомов) А. Обычно такого рода взаимное влияние атомов (X и А) изображают следующим образом:
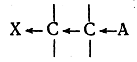
Благодаря индукционному влиянию атома X отрыв атома А в виде катиона в системе I происходит легче, чем в системе II.
Если Y — электроположительный атом (или группа атомов), то он оказывает противоположное индукционное влияние:
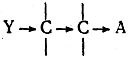
В этом случае разрыв связи С—А с образованием аниона А в системе III облегчен, сравнительно с системой II.
Область явлений, относящихся к взаимному влиянию атомов, непосредственно не связанных друг с другом, весьма обширна. Наиболее характерным примером является различие в силе кислот и оснований, например различная сила жирных кислот при замещении одного из атомов водорода в углеводородной цепи на F, Cl, Br, J, NO2, CN, СН3 и др. Так, константы диссоциации замещенных уксусных кислот показывают, что галоиды, непосредственно не связанные с атомом водорода карбоксильной группы, оказывают на него влияние, отличное в каждом конкретном случае.
Ярким примером подобного взаимного влияния у спиртов служит различие свойств триметилкарбинола и трифторметилдиметилкарбинола:
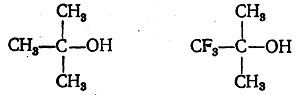
В то время как первый представляет собой один из наименее кислых спиртов, второй является кислотой, вытесняющей угольную кислоту из ее солей.
Характерной особенностью индукционного влияния является то, что оно быстро ослабевает, «затухает» вдоль цепи простых связей.
Если атом или группа атомов обладают электроотрицательным характером, они несколько оттягивают электронную пару от соседнего атома, что вызывает последовательно убывающее индукционное смещение электронных пар других связей в том же направлении (как в хлоруксусной кислоте). В таком случае говорят, что атом или группа атомов проявляет отрицательный индукционный эффект (-I). Если же, наоборот, атом или группа атомов отталкивают электронную пару, то они проявляют положительный индукционный эффект (+I).
Изучение силы различных замещенных кислот позволяет расположить заместители по их индукционному эффекту в следующий ряд:
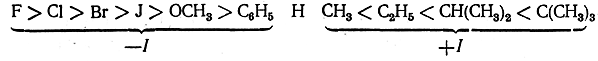
Индукционный эффект водорода принят за нуль. Он выбран за основу для сравнения с ним других атомов и групп атомов.
Следует отличать статический и динамический индукционные эффекты. Статический индукционный эффект (обозначаемый символами I или Is) только что рассмотрен. Если же индукционный механизм обусловливает поляризуемость электронного облака в реагирующей молекуле, то такое электронное смещение называется индуктомерным эффектом и обозначается символом Id .


