Квантово-механические методы расчета молекул органических соединений. Метод электронных пар (метод валентных связей)
Успехи теоретической химии, развитие квантовой механики создали возможность приближенных количественных расчетов молекул. Известно два важнейших метода расчета: метод электронных пар, называемый также методом валентных связей, и метод молекулярных орбит. Первый из этих методов, разработанный Гейтлером и Лондоном для молекулы водорода, приобрел широкое распространение в 30-х годах нынешнего столетия. В последние годы все большее значение приобретает метод молекулярных орбит (Гунд, Э. Хюккель, Мулликен,Герц-берг, Ленард-Джонс).
В этом приближенном методе расчета состояние молекулы описывается так называемой волновой функцией ψ, которая составляется по определенному правилу из ряда слагаемых:
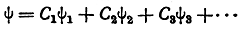
Сумма этих слагаемых должна учитывать все возможные комбинации, возникающие в результате попарного связывания атомов углерода за счет π-электронов.
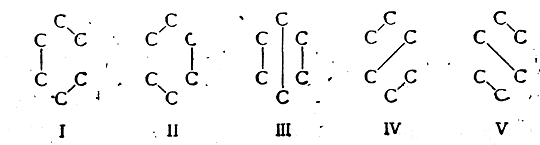
Для того чтобы облегчить расчет волновой функции ψ, отдельные слагаемые (C1ψ1, C2ψ2 и т. д.) условно изображаются графически в виде соответствующих валентных схем, которые используются как вспомогательные средства при математическом расчете. Например, когда указанным способом рассчитывают молекулу бензола и принимают во внимание только π-элек-троны, то таких слагаемых получается пять. Этим слагаемым соответствуют следующие валентные схемы:
Часто приведенные валентные схемы изображают с учетом σ-связей, например для бензола:
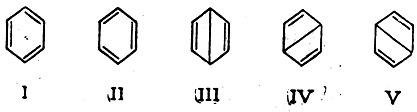
Такие валентные схемы называют «невозмущенными структурами» или «предельными структурами».
Функции ψ1, ψ2, ψ3 и т. д. различных предельных структур входят в волновую функцию ψ с тем большими коэффициентами (с тем большим весом), чем меньше энергия, рассчитанная для соответствующей структуры. Электронное состояние, соответствующее волновой функции ψ, наиболее устойчиво сравнительно с электронными состояниями, изображаемыми функция-
ми ψ1, ψ2, ψ3 и т. д.; энергия же состояния, изображаемого функцией ψ (реальной молекулы), естественно, является наименьшей сравнительно с энергиями предельных структур.
При расчете молекулы бензола по методу электронных пар учитываются пять предельных структур (I—V). Две из них тождественны классической структурной формуле Кекуле и три—формуле Дьюара. Так как энергия электронных состояний, соответствующих предельным структурам III, IV и V, выше, чем для структур I и II, то вклад структур III, IV и V в смешанную волновую функцию молекулы бензола ψменьше, чем вклад структур I и II. Поэтому в первом приближении для изображения распределения электронной плотности в молекуле бензола достаточно двух эквивалентных структур Кекуле.
Около тридцати лет назад Л. Полинг развил качественные эмпирические представления, имеющие некоторые аналогии с методом электронных пар; эти представления были им названы теорией резонанса. Согласно основному постулату этой теории, любая молекула, для которой можно написать несколько классических структурных формул, не может быть правильно изображена ни одной из этих отдельно взятых формул (предельных структур), а только их набором. Качественная картина распределения электронной плотности в реальной молекуле описывается суперпозицией предельных структур (каждая из которых представлена с определенным весом).
Предельные структуры не соответствуют каким-либо реальным электронным состояниям в невозбужденных молекулах, однако не исключено, что они могут осуществляться в возбужденном состоянии или в момент реакции.
Вышеизложенная качественная сторона теории резонанса совпадает с концепцией мезомерии, несколько ранее развитой Инголдом и независимо от него Арндтом.
Согласно этой концепции, истинное состояние молекулы является промежуточным («мезомерным») между состояниями, изображенными двумя или несколькими «предельными структурами», которые можно написать для данной молекулы, пользуясь правилами валентности.
Кроме этого основного положения теории мезомерии, к ее аппарату относятся хорошо разработанные представления об электронных смещениях, в обосновании, интерпретации и опытной проверке которых важная роль принадлежит Инголду. Согласно Инголду, механизмы электронных смещений (электронных эффектов) различны в зависимости от того, осуществляется ли взаимное влияние атомов через цепь простых или сопряженных двойных связей. В первом случае это — индукционный эффект I (или также статический индукционный эффект Is), во втором случае — мезомерный эффект М (статический эффект сопряжения).
В реагирующей молекуле электронное облако может поляризоваться по индукционному механизму; такое электронное смещение называется индуктомерным эффектом Id. В молекулах с сопряженными двойными связями (и в ароматических молекулах) поляризуемость электронного облака в момент реакции обусловлена электромерным эффектом E (динамический эффект сопряжения).
Теория резонанса не вызывает никаких принципиальных возражений, пока речь идет о способах изображения молекул, но она имеет и большие претензии. Аналогично тому, как в методе электронных, пар волновая функция описывается линейной комбинацией других волновых функций ψ1, ψ2, ψ3 и т. д., теория резонанса предлагает описывать истинную волновую функцию ψмолекулы в виде линейной комбинации волновых функций предельных структур.
Однако математика не дает критериев для выбора тех или иных «резонансных структур»: ведь в методе электронных пар волновую функцию можно представить не только как линейную комбинацию волновых функций ψ1, ψ2, ψ3 и т. д., но и как линейную комбинацию любых других функций, подобранных с определенными коэффициентами. Выбор же предельных структур может быть сделан только на основе химических соображений и аналогий, т. е. здесь концепция резонанса по существу не дает ничего нового по сравнению с концепцией мезомерии.
При описании распределения электронной плотности в молекулах с помощью предельных структур необходимо постоянно иметь в виду, что отдельно взятые предельные структуры не соответствуют какому-либо реальному физическому состоянию и что никакого физического явления «электронного резонанса» не существует.
Из литературы известны многочисленные случаи, когда сторонники концепции резонанса приписывали резонансу смысл физического явления и считали, что за определенные свойства веществ ответственны те или иные отдельные предельные структуры. Возможность возникновения таких ошибочных представлений заложена во многих пунктах концепции резонанса. Так, когда говорят о «различных вкладах предельных структур» в реальное состояние молекулы, легко может возникнуть представление о реальном существовании этих соотношений. Реальная молекула в концепции резонанса считается «резонансным гибридом»; этот термин может навести на мысль о якобы реальном взаимодействии предельных структур, подобно гибридизации атомных орбит.
Неудачен также термин «стабилизация за счет резонанса», так как стабилизация молекулы не может быть обусловлена несуществующим резонансом, а представляет собой физическое явление делокализации электронной плотности, характерное для сопряженных систем. Целесообразно поэтому это явление называть стабилизацией за счет сопряжения. Энергия сопряжения (энергия делокализации, или энергия мезомерии) может быть определена экспериментальным путем, независимо от «энергии резонанса», вытекающей из квантово-механических расчетов. Это — разность между энергией, вычисленной для гипотетической молекулы с формулой, соответствующей одной из предельных структур, и энергией, найденной экспериментально для реальной молекулы.
С указанными выше оговорками способ описания распределения электронной плотности в молекулах с помощью нескольких предельных структур несомненно может быть использован наряду с двумя другими также весьма распространенными способами.


