Электронные представления в органической химии
Открытие электронов, установление того факта, что электроны входят в состав каждого атома, и появление теории Бора (1913) о строении атома способствовали дальнейшему развитию теории химического строения благодаря введению в органическую химию электронных представлений.
Одну из электронных гипотез в органической химии выдвинул в России в 1914—1916 гг, А. М. Беркенгейм. Согласно его гипотезе, углерод выполняет смешанные функции, являясь электроположительным по отношению к таким атомам, как хлор, и электроотрицательным по отношению к таким атомам, как водород Эти смешанные функции атом углерода выполняет одновременно по отношению к разным атомам с которыми он связан По теории Беркенгейма химическая связь осуществляется одним электроном В неорганических соединениях этот электрон может полностью перейти от одного атома к другому, после чего атомы будут удерживаться только электростатическими силами В органических молекулах валентный электрон полностью не переходит от одного атома к другому, а только смещается по направлению к одному из них (по современной терминологии—к более электроотрицательному атому).
Формулам органических соединений Беркенгейм придавал следующий вид:
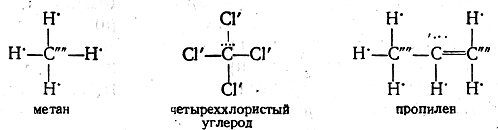
В метане атом углерода проявляет полностью свою отрицательную, а в четыреххлористом углероде — положительную валентность. В пропилене центральный атом углерода проявляет смешанную валентность, будучи в целом положительно заряженным.
Беркенгейм считал, что любая органическая реакция проходит через стадию предварительной диссоциации молекулы на ионы.
Электронная гипотеза Беркенгейма основывалась на предположении, что в органических молекулах действуют только электростатические силы Вследствие такой ограниченности она приводила к ошибочным выводам и была оставлена.
Ограниченность знаний о характере химической связи и природе валентности наложила отпечаток и на другие электронные теории и гипотезы начала нынешнего столетия (Фрай, Фальк и Нельсон, Форлендер). Авторы этих гипотез распространяли представления об электростатических гетерополярных связях (справедливые для большинства неорганических соединений) и на такие симметричные двухатомные молекулы, как молекулы водорода (изображая их как Н+Н-), а также на молекулы углеводородов и других органических веществ, для которых никогда не были обнаружены явления электролитической диссоциации, т е на те связи, которые получили название гомеополярных связей. Чтобы объяснить электростатическими силами свойства соединений с гомео-полярными связями, авторы этих гипотез были вынуждены прибегнуть к ряду не оправдавших себя добавочных гипотетических представлений.
Все эти сходные между собой гипотезы не могли служить основой для электронной интерпретации широкого круга явлений органической химии.
Идея об одновременном участии электронов в электронных оболочках двух соседних атомов явилась основой так называемой октетной теории, возникшей в результате работ Косселя, а затем Льюиса и Лангмюра.
Основное положение этой теории состоит в том, что связь (простая) между атомами всегда образуется не за счет одного,
а за счет двух валентных электронов, которые в результате этого становятся общими для двух атомов. При изображении электронов точками формула молекулы водорода будет иметь вид Н:Н, формула хлористого водорода
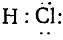
, формула метана
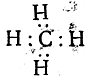
Как видно уже из этих формул, атомы электроотрицательных элементов и в этом случае предполагаются окруженными, подобно атомам инертных газов, кольцом из восьми электронов, называемым октетом, откуда и произошло название самой теории. Но как уже сказано, самым характерным положением этой теории является предположение, что химическая связь (простая) осуществляется парой электронов. В соответствии с этим было предложено изображать простую связь не черточкой, а двумя точками.
Октетная теория явилась существенным прогрессом в уяснении природы химической связи. Она отразила различие между ионной и гомеополярной, или ковалентной, связью, точнее оха-рактеризовала валентность некоторых элементов в их соединениях, в частности азота, кислорода и серы в ониевых солях, ввела понятие о координационной связи и необобщенных, или свободных, электронных парах. Все это позволило более успешно связать химическое строение органических соединений с их реакционной способностью и с их физическими свойствами. Изучение физических свойств органических веществ, проводимое с 20-х годов нашего столетия новейшими физическими методами,позволило дать количественную характеристику химических связей, т. е. определить их длину, энергию, полярность, направление в пространстве и т. д.
Слабая сторона октетной теории заключалась в том, что она в известной степени противоречила распространенным в то время представлениям о строении атома. Согласно этим представлениям, электроны атома не фиксированы в каком-либо определенном месте пространства, а вращаются вокруг ядра с огромными скоростями. В связи с этим было непонятно, как может электронная пара образовать устойчивую, определенно направленную связь между двумя атомами.
Это противоречие было разрешено с возникновением квантовой теории химической связи, когда, исходя из основных положений электронной теории, оказалось возможным (1927) объяснить на примере молекулы водорода образование ковалентной
связи и приближенно рассчитать энергию образования этой молекулы. В дальнейшем успешные расчеты были произведены и для некоторых других простейших молекул.
Наглядная трактовка результатов квантово-механических расчетов в высшей степени затруднительна, так как квантовые свойства электронов не имеют аналогии в классической физике.
Все же можно попытаться изобразить приближенную схему образования ковалентной связи в молекуле водорода следующим образом. Вследствие взаимо действия электронов и ядер распределение плотности электронного облака, соответствующего системе электронов двух атомов водорода, с уменьшением расстояния между ядрами изменяется Характер этого изменения существенно зависит от квантовых свойств электронов, в частности от взаимной ориентации электронных спинов (собственных моментов вращения). В случае антипараллельных электронных спинов электронная плотность в пространстве между ядрами благодаря перекрыванию облаков становится больше, чем она была, когда атомы были изолированы друг от друга. При этом до определенного расстояния между атомами энергия системы уменьшается. Это означает, что атомы притягиваются друг к другу и образуется химическая связь. В случае параллельных спинов электронная плотность в межъядерном пространстве двух атомов уменьшается, энергия системы при сближении атомов повышается, т. е. атомы взаимно отталкиваются и, следовательно, связь между ними не образуется.
В настоящее время создана «целая отрасль науки — квантовая химия, занимающаяся приложением квантово-механических методов к химическим проблемам. Однако было бы принципиально ошибочным думать, что все вопросы строения и реак-ционной способность органических соединений могут быть сведены к задачам квантовой механики. Квантовая механика изучает законы движения электронов и ядер, т. е. законы низшей формы движения, сравнительно с той, которую изучает химия (движение атомов и молекул), а высшая форма движения никогда не может быть сведена к низшей. Даже для весьма простых молекул такие вопросы, как реакционная способность веществ, механизм и кинетика их превращений, не могут быть изучены только методами квантовой механики. Основой изучения химической формы движения материи являются химические методы исследования, и ведущая роль в развитии химии принадлежит теории химического строения.


