§ 4. Подгруппа хрома
По содержанию в земной коре хром (6 ·10–3 %), молибден (3·10–4 %) и вольфрам (6·10–4 %) относятся к довольно распространенным элементам. Встречаются они исключительно в виде соединений.
Основной рудой хрома является природный хромистый железняк (FеО·Cr2 O3 ). Из молибденовых руд наиболее важен минерал молибденит (MoS2 ), из руд вольфрама – минералы вольфрамит (xFeWO4 ·yMnWO4 ) и шеелит (CaWO4 ).
1) Ежегодная мировая добыча хрома составляет около 2 млн. г. Молибдена и вольфрама добывается примерно по 30 тыс. т.
2) При получении элементов подгруппы хрома первой задачей является выделение их окислов. Для этого пользуются обычно следующими схемами процессов. Хромистый железняк сплавляют с содой в присутствии кислорода:
[4(FeO·Cr2 O3 ) + 8Na2 CO3 + 7O2 = 2Fe2 O3 + 8Na2 CrO4 + 8CO2 ]
после чего выделенный из сплава Na2 CrO4 переводят в Na2 Cr2 O7 (по схеме
2Na2 CrO4 + H2 SO4 = Na2 SO4 + Na2 Cr2 O7 )
а последний восстанавливают до Сr2 О3 углем (Na2 Cr2 O7 + 2C = > Cr2 O3 + Na2 CO3 + CO).
Полученный из вольфрамита путем подобного же сплавления с содой (по реакция:
4FeWO4 + 4Na2 CO3 + O2 = 4Na2 WO4 + 2Fe2 O3 + 4CO2
и
6MnWO4 + 6Na2 CO3 + O2 = 6Na2 WO4 + 2Mn3 O4 + 6CO2 )
вольфрамат натрия разлагают соляной кислотой и выделившуюся H2 WO4 нагревают до перехода ее в WO3 . Молибденит переводят в МоО3 обжигом на воздухе: 2MoS2 + 7O2 = 4SO2 + 2MoO3 . Как и в случае марганца, из руд Сr, Мо и W чаще выплавляют не чистые ме таллы, а их высокопроцентные сплавы с железом.
Для выделения элементарного хрома удобно исходить из смеси его окиси (Сr2 О3 ) с порошком алюминия. Начинающаяся при нагревании реакция идет по уравнению:
Сr2 О3 + 2Аl = l12 О3 + 2Cr
Молибден и вольфрам могут быть получены восстановлением их окислов при высоких температурах углем или водородом.
В компактном виде элементы подгруппы хрома представляют собой серозато–белые блестящие металлы. Их важнейшие константы сопоставлены ниже:
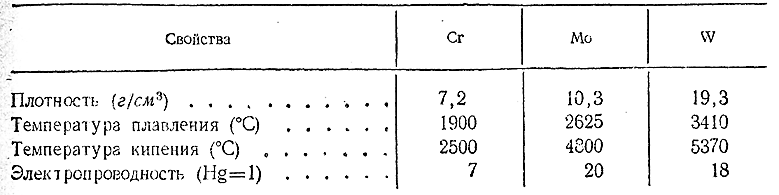
Очень чистые металлы хорошо поддаются механической обработке, но уже следы примесей сообщают им твердость и хрупкость. По,отношению к воздуху и воде Сr, Мо и W при обычных условиях вполне устойчивы. Их основным потребителем является металлургическая промышленность, где эти металлы используются при выработке специальных сталей.
3) Помимо введения в специальные стали, хром используется для покрытия им металлических изделий, поверхность которых должна оказывать большое сопротивление износу (калибры и т. п.). Подобное хромирование осуществляют обычно электролитическим путем, причем толщина наносимых пленок хрома не превышает 0,005 мм. Молибден применяется главным образом при выработке электроламп (из него обычно делают подвески для нитей накала). Так как вольфрам является наиболее тугоплавким и нелетучим из всех металлов, он особенно пригоден для изготовления нитей электроламп и антикатодов мощных рентгеновских трубок. Громадное значение имеет вольфрам также для производства различных сверхтвердых сплавов, употребляемых в качестве наконечников резцов, сверл и т. д.
В обычных условиях все три металла заметно взаимодействуют лишь с фтором, но при достаточном нагревании более или менее энергично соединяются и с другими типичными металлоидами. Общим для них является отсутствие химического взаимодействия с водородом.
При переходе в подгруппе сверху вниз (Ск –> Мо –> W) химическая активность металлов уменьшается. Особенно наглядно сказывается эго на их отношении к кислотам. Хром растворим в разбавленных HCl и H2 SO4 . На молибден последние не действуют, но в горячей крепкой H2 SO4 металл этот растворяется. Вольфрам весьма устойчив по отношению ко всем обычным кислотам и их смесям (кроме смеси HF и HNO3). Перевод молибдена и вольфрама в растворимое состояние легче всего осуществляется путем сплавления с селитрой и содой по схеме:
Э + 3NaNO3 + Na2 CO3 = Na2 ЭO4 + 3NaNO + CO2
Для элементов подгруппы хрома известны соединения, отвечающие различным валентностям, вплоть до VI. Из всех них сколько–нибудь значительное применение находят только производные шестивалентных элементов и трехвалентного хрома, причем важнее других хромовые препараты.
Наиболее характерны для элементов подгруппы хрома те производные, в которых они шестивалентны. Из отвечающих этой валентности трехокисей (ЭО3 ) при накаливании металлов на воздухе образуются лишь бесцветная МоO3 и светло–желтая WO3 . Темно–красная СrО3 может быть получена только, косвенным путем. Все эти трехокиси при обычных условиях тверды.
Будучи типичным кислотным ангидридом, СrО3 легко растворяется в воде с образованием характеризующейся средней силой хромовой кислоты – Н2 Сr04 . Хромовый ангидрид ядовит и является очень сильным окислителем. Уже около 200°С он разлагается по уравнению:
4СrО3 = 2Сr2 О3 + ЗО2
Напротив, МоО3 и WO3 выше 1000°С испаряются без разложения.
Растворимость МоO3 и WO3 в воде очень мала, но в щелочах они растворяются с образованием солей молибденовой и вольфрамовой кислот. Последние в свободном состоянии представляют собой почти нерастворимые порошки белого (Н2 МoО4 ) или желтого (H2 WO4 ) цвета. При нагревании обе кислоты легко отщепляют воду и переходят в соответствующие трехокиси.
В ряду Сr–Мо– W сила кислот Н2 ЭО4 быстро уменьшается. Большинство их солей малорастворимо в воде. Из производных чаще встречающихся металлов хорошо растворимы: хроматы лишь Na+, K+, Mg2+и Са2+, молибдаты и вольфраматы – только Na+и К+. Хромовокислые соли окрашены, как правило, в светло–желтый цвет иона CrO4 2–, молибденово– и вольфрамовокислые – бесцветны.
При взаимодействии СrО3 и газообразного хлористого водорода образуется хлористый хромил (СrО2 Сl2 ), представляющий собой красно–бурую жидкость (т. кип. 117°С). Соединения типа ЭО2 Сl2 (при обычных условиях твердые) известны также для Мо и W. С водой все они взаимодействуют по схеме:
ЭО2 Сl2 + 2Н2 О = > ЭО2 (ОН)2 + 2НСl
В случае хрома равновесие практически нацело смещено вправо, т. е. хлористый хромил (подобно SO2 CI2 ) является типичным хлорангидридом.
Производные Mo и W гидролизованы значительно меньше, что указывает на наличие у молибденовой и вольфрамовой кислот заметно выраженной амфотерности.
4) Продукты полного замещения кислорода трехокисей ЭО3 на галоид известны только для Мо и W. Фториды этих элементов – MoF6 (т. пл. 18 °С
т. кип. 35 °С) и WF6 (т. пл. 2 °С, т. кип. 18 °С) – бесцветны, легкоплавки и очень летучи. Получен также темно–фиолетовый
WCl6 (т. пл. 284 °С, т. кип. 337 °С).
Кроме кислот типа Н2 ЭО4 , для хрома и его аналогов существуют также кислоты, отвечающие общей формуле Н2 Э2 О7 и по строению аналогичные пиросерной кислоте. Наибольшее значение из них имеет двухромовая кислота (Н2 Сr2 07 ). Сама она известна только в растворе, но ее соли (двухромовокислые или бихроматы), особенно К2 Сr2 О7 («хромпик») и Na2 Cr2 07 ·2Н2 О. являются наиболее обычными хромовыми препаратами и исходными продуктами для получения остальных соединений этого элемента.
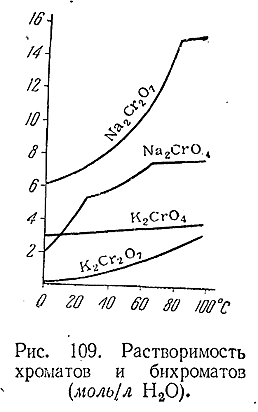
Подобно самому иону Сr2 О7 2–, большинство бихроматов имеет красно–оранжевую окраску. Растворимость их в общем выше,чем соответствующих хроматов. Данные для солей натрия и калия приведены на рис. 109.
Растворы двухромовокислых солей показывают кислую реакцию, обусловленную тем, что ион Сr2 О7 2– реагирует с водой по схеме:
H2 O + Cr2 O7 2– < = > 2HCrO4 1– < = > 2H+ + 2CrO4 2–
Как видно из уравнения, прибавление к раствору кислот (ионов Н+) должно смещать равновесия влево, а прибавление щелочей (ионов ОН–)–вправо. В соответствии с этим из бихроматов легко получить хроматы и наоборот, например по реакциям:
К2 Сr2 O7 + 2КОН = 2К2 СrO4 + Н2 О
2K2 CrO4 + H2 SO4 = K2 SO4 + К2 Сr2 O 7 + Н2 О
Соли хромовых кислот в кислой среде являются сильными окислителями (CrVIвосстанавливается до СrIII). Например, ими уже на холоду окисляется HJ, а при нагревании–даже НВr и НСl. Реакции идут по схеме:
К2 Сr2 O7 + 14HГ = 2КГ + 2СrГ3 + ЗГ2 + 7Н2 0
Обладающая очень сильным окислительным действием смесь равных объемов насыщенного раствора К2 Сr2 О7 и концентрированной H2 SO4 («хромовая смесь») применяется в лабораториях для мытья химической посуды.
5) Хромовая кислота (K1 = 2·10–1; K2 = 3·10–7) значительно слабее двухромовой (K2 = 2·10–2). Последняя является простейшим представителем так называемых изополикислот общей формулы xH2 O·yЭO3 (где у>х), известных в виде их солей. Помимо бихроматов (х = 1, у = 2), были получены трихроматы (x = 1, y = 3) и гетрахроматы (х = 1, у = 4). Образование подобных и более сложных изополисолей особенно характерно для молибдена и вольфрама.
6) Предельным типом изополикислот (y = > бесконечность) являются соответствующие свободные ангидриды. Из них МоО3 и WО3 образуются при накаливании металлов на воздухе. Кристаллы СrО3 выделяются при стоянии смеси 10%–ного раствора К2 Сr2 O7 с концентрированной H2 SO4 (4:1 по объему).
7) Для всех членов подгруппы хрома характерно образование при взаимодействии с Н2 О2 перекисных соединений. В случае самого хрома, помимо синей перекиси CrO3 , известны также соли надкислот H2 Cr2 O12 и Н3 СrO8 . Результаты их изучения говорят в пользу следующих структурных формул:
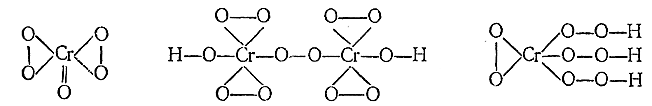
Таким образом, валентность хрома в обеих надкислотах различна. Соли первой из них обычно окрашены в синий, соли второй – в красный цвет.
8) Перекисные соединения молибдена и вольфрама отвечают преимущественно типу М2 ЭОx , где х изменяется от 5 до 8. Все они производятся от шестивалентных элементов и содержат в кислотном радикале от 1 до 4 перекисных групп –О–О–, замещающих отдельные атомы кислорода.
Как уже отмечалось, из производных низших валентностей рассматриваемых элементов существенное практическое значение имеют лишь соединения трехвалентного хрома. Окись хрома (Сr2 О3 ) образуется при энергично протекающем сгорании хрома в кислороде и представляет собой очень тугоплавкое темно–зеленое вещество, нерастворимое не только воде, но и в кислотах. Как Сr2 О3 , так и отвечающие ей соли обычно получают, исходя не из металла, а из производных шестивалентного хрома, например, по реакции:
К2 Сr2 07 + 3SO2 + H2 SO4 = K2 SO4 + Cr2 (SO4 )3 + H2 O
9) В лабораторных условиях окись хрома удобно получать разложением дзухромовокислого аммония. Реакция начинается при нагревании, но дальше протекает сама по уравнению:
(NH4)2 Cr2 O7 = Cr2 O3 + N2 + 4H2 O.
В растворимое состояние окись хрома может быть переведена сплавлением ее с NaNO3 и Na2 CO3 по реакции:
Cr2 O3 + 3NaNO3 + 2Na2 CO3 = 2N2 CrO4 + 3NaNO2 + 2CO2
Из солей окиси хрома (с катионом Сr3+) наиболее интересны хромовые квасцы – темно–фиолетовое кристаллическое соединение состава K2SO4·Cr2 (SO4 )3 ·24H2 O. Действием NH4 OH на их раствор может быть получен серо–синий осадок труднорастворимого в воде гидрата окиси хрома [Сr(ОН)з]. Последний имеет ясно выраженный амфотерный характер. С кислотами он дает соли окиси хрома, а при действии сильных щелочей–соли хромистой кислоты [НСrО2 т. е. Сr(ОН)3 – Н2 О] с анионом СrО2 1–, называемые хромитами. Например:
Сr(ОН)3 + ЗНСl = СrСl3 + ЗН2 О
Сr(ОН)3 + КОН = КCrO3 + 2Н2 О
Таким образом, для растворенной части гидроокиси хрома одновременно имеют место следующие равновесия:
Cr3+ + 3OH– < = > Cr(OH)3
H3 CrO3 < = > H+ + CrO– + H2 O
При прибавлении кислот (Н+) эти равновесия смещаются влево, при прибавлении щелочей (ОН–) – вправо. Сама по себе электролитическая диссоциация Сr(ОН)3 и по тому и по другому направлению невелика, так как и основные, и особенно кислотные свойства гидроокиси хрома выражены довольно слабо. В связи с этим соли трехвалентного хрома подвергаются в растворах значительному гидролизу, а растворимые хромиты при отсутствии избытка щелочи гидролизованы практически нацело. Примером нерастворимого в воде хромита может служить хромистый железняк [Fe(CrO2 )2 ].
Если в кислой среде производные шестивалентного хрома легко восстанавливаются до наиболее устойчивых при этих условиях солей Сr3+, то в щелочной среде производные трехвалентного хрома довольно легко окисляются до хроматов свободными галоидами, перекисью водорода и т. д., например, по реакциям:
2КСгО2 + ЗBr2 + 8КОН = 6КBr + 2К2 Сг04 + 4Н2 О Cr2 (SO4 )3 + ЗН2 О2 + lONaOH = 3Na2 SO4 + 2Naa CrO4 + 8H2 O
Однако под действием кислорода воздуха окисление не идет.
10) Отвечающий двухвалентному хрому хлористый хром (CrCl2 ) образуется при взаимодействии металла с соляной кислотой в атмосфере водорода. Он представляет собой бесцветное кристаллическое вещество, растворяющееся в воде с голубым окрашиванием раствора. Были получены также зеленый CrF2 , желтоватый СrВr2 и красный CrJ2 .
Ион Сr2+ является настолько сильным восстановителем, что способен вытеснять водород по схеме:
2Сr2+ + 2Н– = Cr3+ + H2
Солянокислый раствор СrСl2 иногда применяют для поглощения кислорода. Реакция идет по уравнению:
4СrСl2 + О2 +4НСl = 4СrСl3 + 2Н2 О.
При сопоставлении серы и элементов следующих за ней подгрупп наблюдается полное соответствие данных опыта требованиям учения об электронных аналогах; в производных высшей валентности аналогами серы являются элементы подгруппы хрома; напротив, в соединениях низших валентностей имеет место аналогия по ряду S–Se–Те, тогда как хром и другие члены его подгруппы теряют сходство с серой.
Действительно, кислоты Н2 ЭО4 характерны для всех рассматриваемых элементов, но закономерное уменьшение их силы наблюдается лишь в ряду S– Сr–Mo–W (тогда как селеновая кислота не слабее серной). Характерные для серы и членов подгруппы хрома соединения типа ЭО2 Сl2 у селена и теллура не существуют.
С другой стороны, характерные для S, Se и Те водородные соединения ЭН2 не имеют себе подобных в подгруппе хрома. Точно так же сходны у S, Se и Те окислы ЭО2 и производные от них кислоты Н2 ЭО3 , тогда как для элементов подгруппы хрома соответствующие окислы малохарактерны (и имеют скорее основные свойства).


