Хроматы
ХРОМАТЫ, соли хромовых к-т (см. Хрома оксиды). Наиб. часто встречаются хроматы(VI) - производные СrО3, желтого или красного цвета (табл. 1). Их получают взаимод. р-ров Н2СrО4 (или СrО3) с оксидами, гидроксидами, карбонатами металлов, осаждением из р-ров солей при действии хроматов натрия или К, а также окислением соед., содержащих Сr в низших степенях окисления. Известно неск. относящихся к хроматам минералов, напр. крокоит РbСrО4. Хроматы (VI) большей частью изоморфны с соответствующими сульфатами. Анион CrO42- имеет тетраэдрич. строение.Хроматы щелочных металлов и Mg хорошо раств. в воде, у хроматов щел.-зем. металлов р-римость сильно уменьшается от Са к Ва. Р-ры хроматов имеют щелочную р-цию, хроматы тяжелых металлов в воде большей частью практически не раств., в особенности соли Pb, Bi, Ag, Hg. Хроматы РЗЭ плохо раств., причем соед. элементов иттриевой группы водой разлагаются с образованием основных солей. Хроматы щелочных и щел.-зем. металлов плавятся без разложения, хроматы остальных металлов большей частью разлагаются до плавления.
При подкислении р-ров хроматов образуются дихроматы (бихроматы), что сопровождается переходом их окраски в оранжевую. Дихромат-анион Cr2O72-построен из двух хромкислородных тетраэдров с общей вершиной по атому кислорода. Дихроматы щелочных, щел.-зем. и большинства тяжелых металлов легко раств. в воде. Трудно растворимы дихроматы Ag, Т1. Р-ры дихроматов имеют кислую р-цию. Дихроматы менее термически устойчивы по сравнению с хроматами (VI). Дихроматы - реагенты в дихроматометрии.
Для щелочных (кроме Li) и нек-рых др. металлов известны темно-красные трихроматы М2Сr3О10 и коричнево-красные тетрахроматы М2Сr4О13. Для мн. металлов получены оксохроматы и гидроксохроматы (основные хроматы). Оксо- и гидроксохроматы тяжелых металлов в воде не раств. Описано большое число двойных хроматов, напр. KZn2(CrO4)2OH х Н2О (используются как пигменты), хромато-сульфатов и т.д. Для нек-рых металлов известны хромато-дихроматы, напр. Bi2(CrO4)2Cr2O7. См. также Калия дихромат, Натрия хромат.
При действии Н2О2 на водные р-ры хроматов в зависимости от условий можно получить пероксохроматы: синие - состава
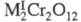 (получают из кислых р-ров) либо красные - состава
(получают из кислых р-ров) либо красные - состава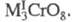 Синие пероксохроматы очень неустойчивы; при ударе, нагревании или соприкосновении с конц. H2SO4 они взрываются. Красные пероксохроматы разлагаются при нагр., при обычных т-рах довольно устойчивы.
Синие пероксохроматы очень неустойчивы; при ударе, нагревании или соприкосновении с конц. H2SO4 они взрываются. Красные пероксохроматы разлагаются при нагр., при обычных т-рах довольно устойчивы. 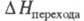 10,0 кДж/моль; т. пл. 973 °С,
10,0 кДж/моль; т. пл. 973 °С,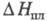 33,0 кДж/моль; р-римость в воде 38,96% по массе при 20 °С; не раств. в этаноле, эфире; получают взаимод. К2Сr2О7 и К2СО3 в водном р-ре; в природе минерал тарапакоит; протрава при крашении, дубитель в кожевенной пром-сти, отбеливатель для масел, воска, протрава для семян, окислитель в орг. синтезе, реагент в хроматометрии.
33,0 кДж/моль; р-римость в воде 38,96% по массе при 20 °С; не раств. в этаноле, эфире; получают взаимод. К2Сr2О7 и К2СО3 в водном р-ре; в природе минерал тарапакоит; протрава при крашении, дубитель в кожевенной пром-сти, отбеливатель для масел, воска, протрава для семян, окислитель в орг. синтезе, реагент в хроматометрии. Хромат (VI) аммония (NH4)2CrO4 - золотисто-желтые кристаллы, р-римость в воде 27,2% по массе при 25 °С, мало раств. в этаноле и в ацетоне; т. разл. 180 °С; при хранении на воздухе постепенно теряет NH3 и превращается в дихромат; получают взаимод. р-ров NH3 с СrО3 или (NH4)2Cr2O7; протрава при крашении тканей, дубящее в-во, компонент светочувствит. слоя фотоматериалов. Дихромат аммония (NH4)2Cr2O7 - оранжево-красные кристаллы; разлагается выше 170 °С, при 240 °С - со вспышкой; р-римость в воде 29,18% по массе при 25 °С, раств. в этаноле, не раств. в ацетоне; получают взаимод. NH4C1 с Na2Cr2O7 в водном р-ре; окислитель в орг. синтезе, отбеливатель для жиров, воска, парафина, компонент светочувствит. слоя фотоматериалов, исходное в-во для синтеза оксидов Сr, катализаторов, получения фоторезисторов, фотосенсибилизаторов, компонент пиротехн. составов, консервант для древесины.
Хромат (VI) кальция СаСrО4 - желтые кристаллы; при 50 °С становится красно-коричневым (при охлаждении окраска восстанавливается); т. пл. ~ 1150 °С (под давлением О2), при атм. давлении т. пл. 1022 °С (с разл.); р-римость в воде 2,27% при 19 °С, 0,79% при 70 °С; из р-ров кристаллизуются ди-, моно- и гемигидраты, обладающие существенно большей р-римостью и полностью обезвоживающиеся при ~ 400 °С; раств. в этаноле; получают взаимод. р-ров Na2Cr2O7 с Са(ОН)2, либо Na2CrO4 с СаС12 с послед. прокаливанием осадка; в природе минерал хроматит; компонент шихты при алюмотермич. получении Сr, пигмент, ингибитор коррозии, компонент покрытий для легких сплавов, деполяризатор для батарей, окислитель при получении Сr.
Хромат (VI) бария ВаСrO4 - желтые кристаллы; т. пл. 1380 °С; практически не раств. в воде и орг. р-рителях, разлагается к-тами; получают взаимод. ВаС12 с К2Сr2О7; окислитель при синтезе красителей, компонент ВВ, пиротехн. составов, антикоррозионных покрытий на стали, составов головок спичек, пигмент (баритовый желтый) для керамики. Хромат (VI) цинка ZnCrO4 - лимонно-желтые кристаллы; разлагается выше 440 °С; практически не раств. в воде; образует гидраты с 7, 2 и 1 молекулами воды; при кипячении с большим кол-вом воды гидролизуется с образованием гидроксохроматов; получают взаимод. Zn(OH)2 с К2Сr2О7; пигмент, компонент антикоррозионных покрытий.
Хромат (VI) свинца РbСrO4 - желтые или оранжево-красные кристаллы; при 707 °С превращается в желтую ромбическую, а при 783 °С - в красную тетрагон. модификации; т. пл. 844 °С (с разл.); практически не раств. в воде и орг. р-рителях; раств. в HNO3, конц. р-рах щелочей; получают взаимод. р-ров нитрата или ацетата Рb с хроматами Na, К или NH+4; пигмент (желтый крон), окислитель в орг. синтезе, компонент материалов термохромных датчиков. Оксохромат свинца
Табл. 1.- СВОЙСТВА НЕКОТОРЫХ XPOMATOB(VI)
| Соединение | Сингония | Параметры кристаллич. решетки | z | Пространств. группа | Плотн., г/см3 | 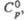 Дж/(моль x К) | 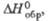 кДж/моль | 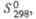 Дж/(моль x К) | ||||
| а, нм | b, нм | с, нм | 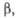 град град | |||||||||
| К2СrO4 | Ромбич. | 0,593 | 1,042 | 0,763 | — | 4 | Ртсп | 2,73 | 146 | -1408 | 200 | |
| (NН4)2СrO4 | Моноклинная | 0,615 | 0,630 | 0,776 | 115,22 | — | — | 1,89 | -1163 | 657 | ||
| (NH4)2CrO7 | Моноклинная | 0,774 | 0,754 | 1,326 | 93,70 | 2 | С2/с | 2,15 | 293 | -1810 | — | |
| СuСrO4 | Ромбич. | 0,5433 | 0,8968 | 0,5990 | — | 4 | Стcm | 4,04 | — | — | — | |
| Ag2CrO4 | Ромбич. | 1,0063 | 0,7029 | 0,5540 | — | 4 | Рпта | 5,62 | 142 | -732 | 218 | |
| СаСrO4 | Тетрагон. | 0,725 | — | 0,634 | — | 4 | I4/amd | 3,12 | 113 | — | 131 | |
| SrCrO4 | Моноклинная | 0,6794 | 0,7131 | 0,6489 | 102,90 | — | — | 3,895 | — | — | — | |
| ВаСrO4 | Ромбич. | 0,9105 | 0,5541 | 0,7343 | — | 4 | Рпта | 4,50 | — | -1429 | 172 | |
| ZnCrO4 | Ромбич. | 0,5505 | 0,8383 | 0,6219 | — | 4 | Стcm | 3,40 | — | — | — | |
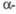 РbСrO4 РbСrO4 | Моноклинная | 0,710 | 0,740 | 0,680 | 77,50 | 4 | Р21/с2 | 6,12 | — | -925 | 167 | |
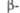 PbCrO4 PbCrO4 | Ромбич. | 0,867 | 0,559 | 0,713 | — | 4 | Рпта | — | — | — | — | |
| Pb2CrO4 | Моноклинная | 1,4018 | 0,5683 | 0,7143 | 115,23 | 4 | C2/m | 6,27 | — | — | — | |
| CoCrO4 | Ромбич. | 0,5516 | 0,8336 | 0,6262 | — | 4 | Стст | 4,08 | — | — | — | |
Табл. 2.- СВОЙСТВА НЕКОТОРЫХ ХРОМАТОВ(III)
| Соединение | Сингония | Параметры кристаллит, решетки, нм | z | Пространств. группа | Т. пл., °С | Плотя., г/см3 | 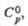 ДжДмоль x К) | 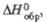 кДж/моль | 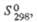 Дж/(моль x К) | |||
| а | b | с | ||||||||||
| NaCrO2 | Тригон. | 0,297 | _ | 1,594 | 3 | 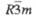 | _ | 4,39 | _ | _ | _ | |
| CuCrO2 | Тригон. | 0,2975 | — | 1,7096 | 3 | 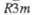 | — | 5,49 | — | -674 | — | |
| CuCr2O4 | Тетрагон. | 0,8532 | — | 0,7788 | — | I4/amd | — | — | — | -1288 | — | |
| MgCr2O4 | Кубич. | 0,8329 | — | — | 8 | Fd3m | 2350 | 4,43 | 127 | -1787 | 106 | |
| CaCr2O4 | Ромбич. | 0,903 | 1,058 | 0,296 | — | — | 2170 | 4,98 | — | -1841 | — | |
| ZnCr2O4 | Кубич. | 0,8337 | — | — | 8 | Fd3m | — | 5,29 | — | -1550 | — | |
| CdCr2O4 | Кубич. | 0,8584 | — | — | 8 | То же | — | 5,79 | — | -1438 | — | |
| MnCr2O4 | Кубич. | 0,8437 | — | — | 8 | " | — | 4,97 | — | — | — | |
| FeCr2O4 | Кубич. | 0,8420 | — | — | 8 | " | 2153 | 5,1 | — | -1452 | 146 | |
| CoCr2O4 | Кубич. | 0,8342 | — | — | 8 | " | — | 5,14 | — | -1430 | 138 | |
| NiCr2O4 | Кубич. | 0,8316 | — | — | 8 | " | — | 5,24 | — | -1382 | 119 | |
| YCrO3 | Ромбич. | 0,5242 | 0,5520 | 0,7534 | 6 | Рbпт | 2430 | 5,76 | 97 | -1555 | 97 | |
| LaCiO3 | Ромбич. | 0,5514 | 0,5478 | 0,7752 | 6 | То же | 2510 | 6,75 | 109 | — | 112 | |
| CeCrO3 | Ромбич. | 0,5475 | 0,5475 | 0,7740 | 6 | " | 2300 | 6,84 | 118 | -1352 | 119 | |
| SmCrO3 | Ромбич. | 0,5367 | 0,5508 | 0,7643 | 6 | " | 2400 | 7,28 | 106 | — | — | |
Pb2CrO5 - оранжевые или красные кристаллы, пигмент (оранжевый крон), материал для термисторов.
Хроматы (V) (иногда их наз. хроманатами) - большей частью черного, голубовато-черного или темно-зеленого цвета, содержат тетраэдрич. анион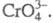 Для щелочных металлов получены соед. типа М3СrО4 и МСr3О8, для щел.-зем.-типа М3(СrО4)2, М2Сr2О7 и М5(СrО4)3ОН, для РЗЭ - типа МСrО4. Получают хроматы (V) термич. разложением хроматов (VI) в смеси с оксидом или нитратом соответствующего металла, гидротермальным путем, взаимод. оксидов при высоких давлениях и т. д. Мало раств. в воде, при кипячении с водой гидролизуются с диспропорционированием на Сr(III) и Cr(VI).
Для щелочных металлов получены соед. типа М3СrО4 и МСr3О8, для щел.-зем.-типа М3(СrО4)2, М2Сr2О7 и М5(СrО4)3ОН, для РЗЭ - типа МСrО4. Получают хроматы (V) термич. разложением хроматов (VI) в смеси с оксидом или нитратом соответствующего металла, гидротермальным путем, взаимод. оксидов при высоких давлениях и т. д. Мало раств. в воде, при кипячении с водой гидролизуются с диспропорционированием на Сr(III) и Cr(VI).
Хроматы(IV) большей частью представляют собой сложные оксиды, хотя в структуре нек-рых из них имеется тетраэдрич. анион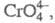 преим. зеленого цвета. Для щелочных металлов известны хроматы типа М2СrО3 и М4СrO4, для щел.-зем.- типа МСrО3, М2СrО4, М3СrО5 и М4СeO6.
преим. зеленого цвета. Для щелочных металлов известны хроматы типа М2СrО3 и М4СrO4, для щел.-зем.- типа МСrО3, М2СrО4, М3СrО5 и М4СeO6.
Хроматы (III) (устар. назв. хромиты) представляют собой сложные оксиды (табл. 2). Хроматы (III) металлов в степени окисления + 1имеют состав МСrО2 (метахромиты), получены также М3СrO3 (ортохромиты). Для металлов в степени окисления +2 характерны соед. МСr2О4 (многие из них имеют структуры типа шпинели). РЗЭ, кроме Sc, дают соед. МСrО3 со структурами типа перовскита. Получают хроматы(III) спеканием Сr2О3 с оксидами, карбонатами и др. соед. металлов, а также восстановлением или термич. разложением хроматов (VI) и дихро-матов(VI). Из р-ров, получающихся в результате р-рения гидроксида Сr(III) в щелочи, кристаллизуются гидроксохроматы(III) состава МСr(ОН)4, М3Сr(ОН)6 и даже М4Сr(ОН)7. Для щел.-зем. металлов получены гидроксохроматы типа М3Сr2(ОН)2 со структурой типа граната. Хроматы (III) в осн. тугоплавки, химически стойки.
Хромат (III) магния MgCr2O4 - темно-зеленые, серо-зеленые или красные кристаллы; получают нагреванием MgCr2O7 или спеканием MgO с Сr2О3 с добавкой В2О3; в природе минерал магнезиохромит; компонент огнеупоров, катализатор орг. синтеза. Хромат (III) цинка ZnCr2O4 - светло-зеленые кристаллы; получают прокаливанием смеси нитратов Zn и Сr или термич. разложением ZnCr2O7; катализатор орг. синтеза, компонент керамич. датчиков влажности. Хромат (III) железа(II) FeCr2O4 - черные или темно-коричневые кристаллы; получают нагреванием смеси FeCl3 + К2Сr2О7 или Fe2O3 + Сr2О3 с добавкой Н3ВО3; в природе минерал хромит; компонент огнеупоров, катализатор орг. синтеза; природный - сырье для извлечения Сr. См. также Лантана хромат.
Известны хроматы, содержащие Сr в двух степенях окисления, в частности +3 и +4 (напр., Sr4Cr2O9), +4 и +6 [Са5(СrО4)3] или +5 и +6 [Са10(СrО4)7]. Иногда их наз. хромито-хроматами, а состав выражают ф-лой mMO x nCrO3 xpCr2O3.
Хроматы и дихроматы Na, К и аммония обладают местным и общим токсич. действием. Их аэрозоли вызывают прободение хрящевой части носовой перегородки, воспаление гортани и придатков носовой полости. Могут вызвать тяжелые ожоги кожи, экзему, язвы. Поражают органы дыхания и желудочно-кишечный тракт. Токсична пыль и нерастворимых хроматов, нек-рые канцерогенны. ПДК хроматов (в пересчете на СrО3) 0,01 мг/м3.
П. И. Федоров.
