Азулены
АЗУЛЕНЫ (бицикло[5.3.0]декапентаены), небензоидные ароматич. соед., содержащие конденсированную систему из 5- и 7-членного циклов.
Все атомы углерода 5-членного цикла несут небольшой отрицат. заряд, 7-членного (кроме атомов углерода, общих для обоих циклов) — положительный, вследствие чего азулены обладают дипольным моментом.
 Азулены-обычно кристаллы синего или сине-фиолетового цвета; перегоняются с паром. Раств. в углеводородах. Выше 300°С изомеризуются в нафталин и его гомологи. В УФ-спектрах максимумы поглощения в области 550-700 нм. В ИК-спектрах характеристич. полосы при частотах 1570-1577 см-1 (С—С) и 3030-3086 см-1(С-Н).
Азулены-обычно кристаллы синего или сине-фиолетового цвета; перегоняются с паром. Раств. в углеводородах. Выше 300°С изомеризуются в нафталин и его гомологи. В УФ-спектрах максимумы поглощения в области 550-700 нм. В ИК-спектрах характеристич. полосы при частотах 1570-1577 см-1 (С—С) и 3030-3086 см-1(С-Н).
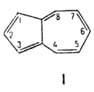
Простейший представитель азуленов - азулен (ф-ла I): синие кристаллы, т. пл. 99 °С, т. кип. 170°С;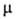 3,333 * 10-30 Кл*м. Энергия стабилизации 72 кДж/моль. Гидрируется, окисляется на воздухе и под действием КМnО4 с образованием СО2, (СООН)2 и др.
3,333 * 10-30 Кл*м. Энергия стабилизации 72 кДж/моль. Гидрируется, окисляется на воздухе и под действием КМnО4 с образованием СО2, (СООН)2 и др.
Азулены содержатся в эфирных маслах и поэтому для них сохранились названия, образованные прибавлением к слову "азулен" части латинского названия соответствующего растения, напр. гвайазулен (1,4-диметил-7-изопропилазулен)-из древесины Guaiacum officinali L., хамазулен (1,4-диметил-7-этилазулен)-из ромашки Matricaria chamomilla L.
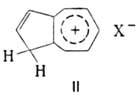
Вследствие повыш. электронной плотности на атомах углерода 5-членного цикла азулены проявляют высокую активность в р-циях с электроф. агентами. Они легко образуют комплексы с электронодефицитными соед., напр. тринитробензолом, пикриновой к-той, тетрацианхинодиметаном, карбонилами металлов. Благодаря высокой основности при действии минер. или апротонных к-т азулены образуют соли, напр. ф-лы II. Способность растворяться в 60%-ной H2SO4 или 85%-ной Н3РО4 с образованием солей используется для выделения азуленов, поскольку соль гидролизуется при разбавлении кислотного раствора водой.
комплексы с электронодефицитными соед., напр. тринитробензолом, пикриновой к-той, тетрацианхинодиметаном, карбонилами металлов. Благодаря высокой основности при действии минер. или апротонных к-т азулены образуют соли, напр. ф-лы II. Способность растворяться в 60%-ной H2SO4 или 85%-ной Н3РО4 с образованием солей используется для выделения азуленов, поскольку соль гидролизуется при разбавлении кислотного раствора водой.
Биполярное строение объясняет большую легкость электроф. замещения в азуленах, чем в ароматич. соединениях, причем первый заместитель вступает в положение 1, второй-в 3. В этих р-циях (напр., нитрование, галогенирование, ацилирование, азосочетание) азулены по реакц. способности аналогичны высокоактивным 5-членным гетероциклам. Радикальное замещение при взаимод. азуленов с нитрозоацетанилидом или диазосоединениями происходит также в положение 1 или 3. Нуклеоф. реагенты (напр., RLi, RMgX) вступают в положение 4 или 8, а также 6.
В пром-сти азулены получают дегидрированием в присут. окислителей (S или Se) сесквитерпенов, выделяемых из эфирных масел, напр. гвайазулен синтезируют дегидратацией гвайола, выделенного из масла древесины гваяка, с послед. дегидрированием: 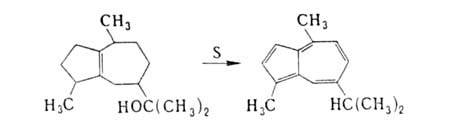
Наиб. удобен синтез из солей пиридиния или пирилия и ци-клопентадиена или их гомологов, напр.: 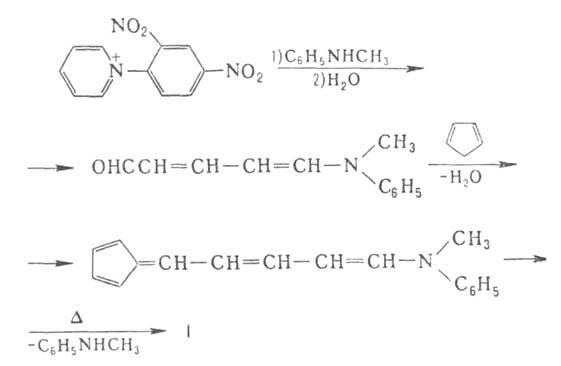
Многие азулены обладают бактериостатич. и противовоспалит. активностью, благодаря чему их широко применяют как компоненты зубных паст и косметич. изделий.
Литература
Хельброннер Е., в кн.: Небензоидные ароматические соединения, пер. с англ., М., 1963, с. 176-278; Мочалин В. Б., Поршнев Ю. Н., "Успехи химии", 1977, т. 46, в. 6, с. 1002-40. Р. Я. Попова.
