Аммины
АММИНЫ [от амм(иак)\ (аммиакаты, амминокомплексы), координационные соед., содержащие в кач-ве лигандов одну или неск. молекул NH3. Последнюю в роли лиганда наз. "аммин"; она связана с центр, атомом металла через атом N. Различают аммины анионного типа (напр., K[PtCl3(NH3)]), катионного (напр., [Pt(NH3)4]Cl2) и комплексы-неэлектролиты (напр., [PtCl2(NH3)2]). В зависимости от числа молекул координированного NH3 аммины часто подразделяют на моно-, ди-, три-, тетр-, пент- и гексаммины.
Для амминов характерна внутрисферная амидореакция - отщепление протона от NH, под действием оснований, напр.:
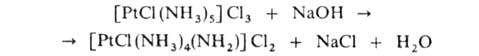
Под действием к-т или воды амидогруппа NH-2 снова превращается в NH3. Благодаря амидореакции аммины обладают в водных р-рах кислотными св-вами, напр. для [PtCl(NH3)5]Cl3 концентрационные константы кислотной диссоциации К1 и К2соотв. 7,9*10-9 и 4,6*10-11. Кислотные св-ва амминов, как правило, в ряду комплексов с одинаковой геом. конфигурацией, с одним и тем же центр. атомом в одинаковых состояниях окисления усиливаются с ростом т-ры и числа молекул NH3. При хлорировании аммины могут образовываться комплексы с лигандами NH2C1, NHC12, NC1-2., напр. [PtCl3(NH3)2NCl2]. Аммины часто являются восстановителями, участвуют в р-циях внутрисферного замещения молекул NH3 на др. лиганды. Аммины нек-рых металлов, напр. Sc(III), легко гидролизуются с образованием гидроксокомплексов и ионов аммония.
Аммины обычно получают действием NH3 в водном р-ре на простые или комплексные соли металлов, напр.:
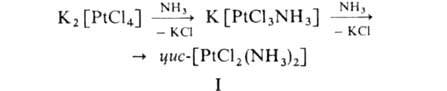
Они также образуются в результате присоединения газообразного NH3 к солям в отсутствие р-рителя. Применяют аммины для синтеза координационных соед. металлов, для обнаружения ряда ионов (напр., Сu2+), как лек. ср-ва [напр., цис-дихлордиамминплатина (ф-ла I) - противоопухолевый препарат]. Нек-рые аммины-промежут. продукты при получении металлов высокой степени чистоты (напр., спектрально чистой Pt), металлич. покрытий и пленок. Ю.Я. Харитонов.
