Когeзия
КОГEЗИЯ (от лат. cohaesus - связанный, сцепленный), сцепление частей одного и того же однородного тела (жидкого или твердого). Обусловлена хим. связью между составляющими тело частицами (атомами, ионами) и межмол. взаимодействием. Работой когезии наз. свободную энергию разделения тела на части и удаления их на такое расстояние, когда нарушается целостность тела. Работу когезии Wc определяют как работу обратимого изотермич. разрушения тела: Wc=2g, где g - уд. поверхностная энергия (для твердых тел) или поверхностное натяжение (для жидкостей). Соотношение Wc и работы адгезии Wa, характеризующей сцепление разнородных тел (см. Адгезия), служит для определения способности жидкостей смачивать твердые тела: при Wa < 1/2Wc имеет место несмачивание, при 1/2Wc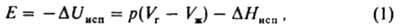
где DHисп энтальпия испарения, индексы "г" и "ж" означают газообразное и жидкое состояния в-ва соответственно. При Vг>>Vж и при условиях, когда пар ведет себя как идеальный газ, справедливо соотношение:

(R газовая постоянная). Значения Е и Ес определяют экспериментально по данным калориметрии; используют также эмпирич. соотношение Гильдебранда DHисп=0,02 Т2ксп+27,3Ткип — 2950. Приближенные расчеты Ес основаны на предположении об аддитивности вкладов в плотность энергии когезии энергий хим. связей, соединяющих атомы (инкрементов) DЕi: когезия низкомол. в-в связана с их агрегатным состоянием
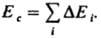 и служит для оценки св-в (термодинамич., мех. и др.). Когезионные характеристики низкомол. жидкостей и твердых тел чувствительны к их хим. природе. Так, введение в молекулы углеводородов атомов галогенов приводит к увеличению Ес от 8-25 до 10-44 кДж/моль, азота - до 14-42 кДж/моль, серы - до 12-52 кДж/моль. При введении гидроксильных, карбонильных и карбоксильных групп Ес увеличивается соотв. до 20-60, 11-30 и 22-35 кДж/моль.
и служит для оценки св-в (термодинамич., мех. и др.). Когезионные характеристики низкомол. жидкостей и твердых тел чувствительны к их хим. природе. Так, введение в молекулы углеводородов атомов галогенов приводит к увеличению Ес от 8-25 до 10-44 кДж/моль, азота - до 14-42 кДж/моль, серы - до 12-52 кДж/моль. При введении гидроксильных, карбонильных и карбоксильных групп Ес увеличивается соотв. до 20-60, 11-30 и 22-35 кДж/моль. 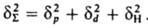
Для воды значение dS определяется в осн. наличием водородной связи и диполь-дипольным взаимод. (dН=34,2, dр=31,3,dd=12,3 МДж0,5/м1,5). Для углеводородных жидкостей с полярными галогени азотсодержащими молекулами dр соотв. в 2 и 5-10 раз больше, чем для незамещенных углеводородов. Для техн. углерода dd=21,1, dр=12,3, dН=11,2 МДж0,5/м1,5. Для полимеров отдельные составляющие dS выделить труднее; по-видимому, из-за больших размеров макромолекул нивелируются различия в межмол. взаимод. функц. групп. Лит. Аскадский А А., Матвеев Ю И., Химическое строение и физические свойства полимеров, М., 1983; Вакула В Л., Притыкин Л М, Физическая химия адгезии полимеров, М, 1984; Притыкин Л М и др., "Высокомолекулярные соединения", 1985. т 27А, № 1, с. 24 9; 1663 75, Роул и неон Д. Ш.. Уидом Б., Молекулярная теория капиллярности, пер с англ., М , 1986; Garden J L, "J Colloid and Interfase So.", 1977, v 59, № 3. 582 96. Л М Притыкин
Ещё по теме
Когезия и её влияние на свойства веществ
Адгезия — причины и примеры явления
Межфазовое натяжение и адгезия
Смачивание — основные аспекты и значение явления
Смачивание и растекание жидкостей на поверхности твёрдых тел
Физико-химическая гидродинамика — механизмы и закономерности переноса
Вискозиметрическое определение гидратации полимерных частиц
Адгезия частиц к твёрдой поверхности и роль капиллярной конденсации
Устойчивость и коагуляция коллоидных систем
Сжимаемость веществ — основные понятия и применение
Поверхностное натяжение и адсорбция в гетерогенных системах
Макрокинетика — основы и практическое применение
Теория Мейера и её развитие в работах учёных
Поверхностные явления и адсорбция — основные понятия и термины
Вязкость разбавленных дисперсных систем — уравнения и факторы влияния
Поверхностные явления в физике и химии
