Термодинамическое равновесие
ТЕРМОДИНАМИЧЕСКОЕ РАВНОВЕСИЕ, состояние термодинамич. системы, не изменяющееся во времени и не сопровождающееся переносом через систему в-ва или энергии. Если состояние системы не изменяется во времени, но есть поток в-ва или энергии через систему, состояние системы наз. стационарным. Изолированная система, не обменивающаяся со средой в-вом и энергией, со временем всегда приходит к термодинамическому равновесию и не может самопроизвольно из него выйти. Постепенный переход системы из неравновесного состояния, вызванного внеш. воздействием, в состояние термодинамического равновесия наз. релаксацией.
Термодинамическое равновесие включает: термич. равновесие -постоянство т-ры в объеме системы, отсутствие градиентов т-ры; мех. равновесие, при к-ром невозможны никакие макроскопич. перемещения частей системы, т. е. имеется равенство давления в объеме системы; допустимы, однако, движения системы как целого-поступат. движение в поле действия внеш. сил и вращение. В случае гетерог. системы сосуществование термодинамически равновесных фаз наз. фазовым равновесием. Если между компонентами системы происходят хим. р-ции, в состоянии термодинамического равновесия скорости прямых и обратных процессов равны между собой (см. Химическое равновесие). При термодинамическом равновесии в системе прекращаются все необратимые переноса процессы (теплопроводность, диффузия, вязкое течение и т.п.). В системе не наблюдается изменение концентраций реагирующих в-в, для закрытой системы характерно равновесное распределение компонентов между составляющими систему фазами. Параметры состояния, определяющие термодинамическое равновесие, строго говоря, не являются постоянными, а флуктуируют около нек-рых статистич. средних значений; обычно эти флуктуации пренебрежимо малы.
Принцип равновесия Гиббса. Для k-компонентной r-фазной системы при постоянстве ее внутренней энергии U, объема V и чисел молей компонентов ni (i = 1, 2, ..., k) условие термодинамического равновесия заключается в том, что при всех возможных изменениях параметров состояния энтропия 5 системы остается неизменной или уменьшается. Иными словами, энтропия изо-лир. системы при термодинамическом равновесии имеет условный максимум:
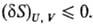
Буква d означает бесконечно малую вариацию величины, в т.ч. флуктуацию, в отличие от знака дифференциала, означающего действительно малое изменение величины в реальном процессе. Знак равенства имеет место при протекании в системе обратимых процессов, знак неравенства-необратимых (в случае изолир. системы). Принцип равновесия можно выразить также через термодинамические потен-циалы-внутр. энергию U, энтальпию H, энергию Гиббса G, энергию Гельмгольца F-при условиях, характеризуемых постоянством соответствующих параметров состояния. Термодинамическому равновесию отвечает условный минимум термодинамич. потенциалов:
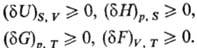
Переход системы из одного состояния термодинамического равновесия в другое может происходить через последовательность состояний, каждое из к-рых является также состоянием термодинамического равновесия. Это означает, что параметры состояния в течение всего процесса перехода бесконечно мало отличаются от своих значений при термодинамическом равновесии. Это-равновесный (квазистатический) процесс. Реальные процессы перехода всегда неравновесны; они изучаются химической термодинамикой.
Наряду с основным (глобальным) максимумом энтропии и минимумами термодинамич. потенциалов, отвечающими стабильному термодинамическому равновесию, в пространстве параметров состояния возможны локальные максимумы энтропии и минимумы термодинамич. потенциалов. Соответствующие им состояния системы наз. метастабильными равновесиями. Такие состояния, как и состояние стабильного термодинамического равновесия, локально устойчивы, т.е. устойчивы к бесконечно малым изменениям параметров состояния. Но метастабильные состояния термодинамического равновесия могут быть неустойчивыми при нек-рых конечных изменениях параметров.
Под локальным термодинамическим равновесием в термодинамике неравновесных процессов подразумевается равновесие в очень малых (элементарных) объемах среды, содержащих все же достаточное число частиц (атомов, молекул, ионов), чтобы состояние этих объемов можно было характеризовать т-рой, давлением, хим. потенциалом и др. термодинамич. потенциалами, но не постоянными, а зависящими от координат и времени. При локальном термодинамическом равновесии элементарных объемов состояние системы в целом неравновесное.
Лит. см. при ст. Химическая термодинамика. П. И. Федоров.
