Переаминирование
ПЕРЕАМИНИРОВАНИЕ (трансаминирование), обратимый перенос аминогруппы из молекулы одного орг. соед. в молекулу другого. Наиб. роль переаминирование играет в биохимии в процессах метаболизма азотистых оснований в тканях животных и растений. Заключается в переносе аминогруппы от молекулы a-аминокислоты в молекулу a-кетокислоты, как правило с участием ферментов - аминотрансфераз (трансаминаз), напр. по р-ции:
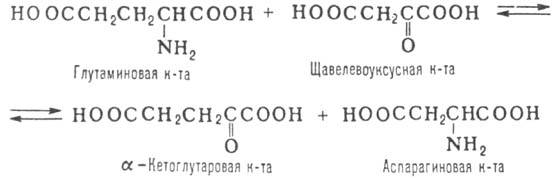
В живых организмах на р-циях такого типа основываются синтез и диссимиляция аминокислот.
Аминотрансферазы (более 50 разновидностей) содержат в качестве кофсрмента производные витамина В6-пири-доксаль-5'-фосфат (ф-ла I) и пиридоксамин-5'-фосфат (II). В основе каталитич. активности пиридоксаль-5'-фосфата лежит способность его формильной группы образовывать с аминокислотами шиффовы основания, легко гидролизующиеся до пиридоксамин-5'-фосфата и a-кетокислоты. Общая схема переаминирования с участием этих ферментов представляет собой сумму двух полуреакций:
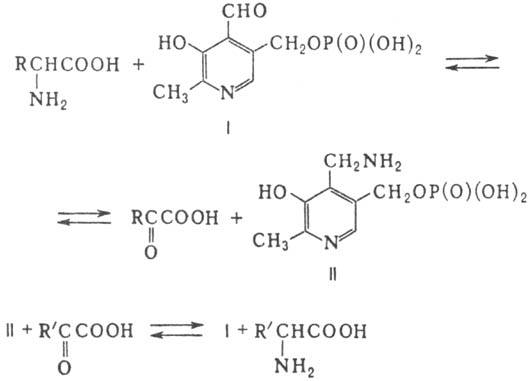
A. E. Браунштейн и M. M. Шемякин в 1953 сформулировали общий механизм переаминирования в биол. системах, состоящий из ряда промежут. стадий. Подробно механизм переаминирования под действием аминотрансфераз рассмотрен в ст. Аспартатаминотранс· фераза.
Нарушение нормального течения переаминирования в организме наблюдается при патологич. состояниях, напр. при инфаркте миокарда, заболеваниях печени. Контроль концентрации аминотрансфераз используется в этих случаях как ср-во диагностики. Переаминирование в организме подавляется противотуберкулезными лек. ср-вами (изониазидом, циклосерином и др.), а также при В6-авитаминозе.
Переаминирование аминокислот может происходить и вне клетки в присут. пиридоксаль-5'-фосфата, однако скорость р-ции в 106 раз меньше. Специфичность действия определяется пространств, структурой субстрата, положением ионогенных групп белка, осуществляющих кислотно-основной катализ, и геометрией связывания субстрата.
В орг. химии примером переаминирования может служить обмен одной аминогруппы в молекуле на другую при р-ции с аминами:
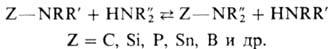
Сдвиг равновесия определяется разностью основностей исходных аминов и продуктов р-ции, а также соотношением концентраций реагентов. Проводят р-ции при повыш. т-ре в присут. катализаторов (к-ты, основания, нек-рые металлы или их оксиды) или без них; протекает обычно по механизму SN2. Каталитическое переаминирование в зависимости от агрегатного состояния катализатора осуществляют в жидкой фазе под давлением или в газовой фазе.
К переаминированию относят также превращ. a-кетокислоты в a-амино-кислоту при нагр. с др. аминокислотой в водном р-ре (р-ция Хербста - Энгеля):
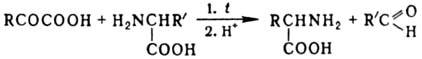
Лит.: Геллер Б. А., "Успехи химии", 1978, т. 47, в. 3, с. 537-56; Мецлер Д., Биохимия, пер. с англ., т. 2, M., 1980, с. 209-32; Браун-штейн A. E., Процессы и ферменты клеточного метаболизма. Сб. статей, M., 1987; Марч Дж., Органическая химия, пер. с англ., т. 2, M., 1988, с. 150.
M. В. Шиманская.
