Карбонаты неорганические
КАРБОНАТЫ НЕОРГАНИЧЕСКИЕ (от лат. carbo, род. падеж carbonis - уголь), соли угольной к-ты. Существуют средние карбонаты с анионом СО32- и кислые, или гидрокарбонаты (устар. бикарбонаты), с анионом HCO3-. Карбонаты - кристаллич. в-ва. Большинство средних солей металлов в степени окисления +2 кристаллизуется в гексагoн. решетке типа кальцита или ромбич. типа арагонита. Из средних карбонатов в воде раств. только соли щелочных металлов, аммония и Тl(I). В результате значит. гидролиза их р-ры имеют щелочную р-цию. наиб. трудно раств. карбонаты металлов в степени окисления +2 (см. табл.). Напротив, все гидрокарбонаты хорошо раств. в воде. При обменных р-циях в водных р-рах между солями металлов и Na2CO3 осадки средних карбонатов образуются в тех случаях, когда их р-римость значительно меньше, чем соответствующих гидроксидов. Это имеет место для Са, Sr и их аналогов, лантаноидов, Ag(I), Mn(II), Pb(II) и Cd(II).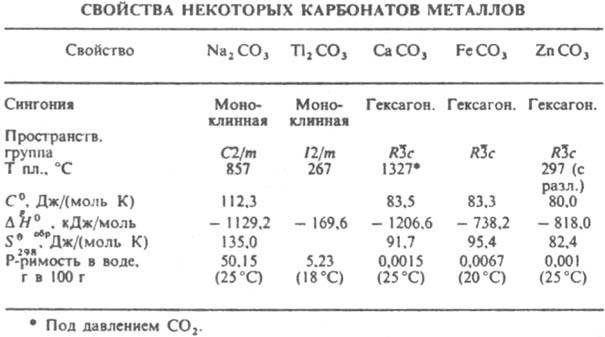
Остальные катионы при взаимод. с растворенными карбонатами в результате гидролиза могут давать не средние, а основные карбонаты или даже гидроксиды. Средние карбонаты, содержащие многозарядные катионы, иногда удается осадить из водных р-ров в присут. большого избытка СО2. Хим. св-ва карбонатов обусловлены их принадлежностью к классу неорг. солей слабых к-т. Характерные особенности карбонатов связаны с их плохой р-римостью, а также термич. нестойкостью как самих карбонатов, так и Н2СО3. Эти св-ва используются при анализе карбонатов, основанном либо на их разложении сильными к-тами и количеств. поглощении выделяющегося при этом СО2 р-ром щелочи, либо на осаждении иона СО32- из р-ра в виде ВаСО3. При действии избытка СО2 на осадок среднего карбоната в р-ре образуется гидрокарбонат, напр.: СаСО3 + Н2О + СО2 : Са(НСО3)2. Присутствие гидрокарбонатов в прир. воде обусловливает ее временную жесткость (см. Жесткость воды). Гидрокарбонаты при легком нагр. уже при низких т-рах вновь превращаются в средние карбонаты, к-рые при нагр. разлагаются до оксида и СО2. Чем активнее металл, тем выше т-ра разложения его карбоната. Так, Na2CO3 плавится без разложения при 857 °С, а для карбонатов Са, Mg и Аl равновесные давления разложения достигают 0,1 МПа при т-рах соотв. 820, 350 и 100 °С. Карбонаты весьма широко распространены в природе, что обусловлено участием СО2 и Н2О в процессах минералообразования. Карбонаты играют большую роль в глобальных равновесиях между газообразным СО2 в атмосфере, растворенным СО2 и ионами HCO3- и СО32- в гидросфере и твердыми солями в литосфере. Важнейшие минералы - кальцит СаСО3, магнезит MgCO3, сидерит FeCO3, смитсонит ZnCO3 и нек-рые др. (см. Карбонаты природные). Известняк состоит в осн. из кальцита или кальцитовых скелетных остатков организмов, редко из арагонита. Известны также прир. гидратированные карбонаты щелочных металлов и Mg (напр., MgCO3.3H2O, Na2CO3.10H2O), двойные карбонаты [напр., доломит CaMg(CO3)2, трона Na2CO3.NaHCO3.2H2O] и основные [малахит CuCO3.Cu(OH)2, гидроцеруссит 2РbСО3.Рb(ОН)2]. Hаиб. важны калия карбонат, кальция карбонат и натрия карбонат. Мн. прир. карбонаты весьма ценные металлич. руды (напр., карбонаты Zn, Fe, Mn, Pb, Cu). Гидрокарбонаты выполняют важную физиол. роль, являясь буферными в-вами, регулирующими постоянство рН крови. П. М. Чукуров.
Синонимы/примеры:*
Карбонат натрия; Карбонат калия; Карбонат кальция; Карбонат магния; Карбонат бария; Карбонат аммония
*подобраны ИИ, возможны неточности
Ещё по теме
Карбонаты — свойства и применение
Натрия карбонат — свойства и применение
Карбанионы — строение и роль в органических реакциях
Кальция карбонат — свойства и применение
Свойства и применение карбоната никеля
Карбонилы металлов — свойства и применение
