Гафний
Гафний (лат. Hafnium), Hf, химический элемент IV группы периодической системы Менделеева; порядковый номер 72, атомная масса 178, 49; серебристо-белый металл. В состав природного гафния входят 6 стабильных изотопов с массовыми числами 174, 176—180. Существование гафния было предсказано Д. И. Менделеевым в 1870. В 1921 Н. Бор показал, что элемент № 72 должен иметь строение атома, подобное цирконию, и что, следовательно, его надо искать не среди редкоземельных элементов, как думали раньше, а среди минералов циркония. Венгерский химик Д. Хевеши и голландский физик Д. Костер систематически исследовали минералы циркония методом рентгеноспектрального анализа и в 1922 обнаружили элемент № 72, назвав его гафнием по месту открытия — городу Копенгагену (позднелат. Hafnia).
Гафний не имеет собственных минералов и в природе обычно сопутствует цирконию. В земной коре содержится 3,2·10-4% гафния по массе, в большинстве циркониевых минералов его содержание составляет от 1—2 до 6—7%, во вторичных минералах — иногда до 35%. Наиболее ценным промышленным типом месторождений гафния являются морские и аллювиальные россыпи минерала циркона (см. Цирконий).
Физические и химические свойства. При обычной температуре гафний имеет гексагональную решётку с периодами а = 3,1946 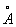 и с = 5,0511
и с = 5,0511 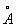 . Плотность гафния 13,09 г/см3 (20 °С). Гафний тугоплавок, его tпл 2222 ± 30 °С, tkип 5400 °С. Атомная теплоёмкость 26,3 кдж/(кг-атом·К) [6,27 кал/(г-атом ´ град)] (25—100° С); удельное электросопротивление 32,4·10-8 ом·м (0°С). Особенность гафния — высокая эмиссионная способность; работа выхода электрона 5,77 ´ 10-19 дж, или 3,60 эв (980—1550°С); гафний имеет высокое сечение захвата тепловых нейтронов, равное 115·10-28 м2, или 115 барн (у циркония 0,18·10-28 м2, или 0,18 барн). Чистый гафний пластичен, легко поддаётся холодной и горячей обработке (прокатке, ковке, штамповке).
. Плотность гафния 13,09 г/см3 (20 °С). Гафний тугоплавок, его tпл 2222 ± 30 °С, tkип 5400 °С. Атомная теплоёмкость 26,3 кдж/(кг-атом·К) [6,27 кал/(г-атом ´ град)] (25—100° С); удельное электросопротивление 32,4·10-8 ом·м (0°С). Особенность гафния — высокая эмиссионная способность; работа выхода электрона 5,77 ´ 10-19 дж, или 3,60 эв (980—1550°С); гафний имеет высокое сечение захвата тепловых нейтронов, равное 115·10-28 м2, или 115 барн (у циркония 0,18·10-28 м2, или 0,18 барн). Чистый гафний пластичен, легко поддаётся холодной и горячей обработке (прокатке, ковке, штамповке).
По химическим свойствам гафний очень похож на цирконий вследствие почти одинаковых размеров ионов этих элементов и полного сходства электронной структуры. Однако химическая активность гафния несколько меньше, чем Zr. Основная валентность гафния равна 4. Известны также соединения 3-, 2- и 1-валентного гафния.
При комнатной температуре компактный гафний совершенно устойчив к атмосферным газам. Однако при нагревании выше 600 °С быстро окисляется и взаимодействует, подобно цирконию, с азотом и водородом. Гафний отличается коррозионной стойкостью в чистой воде и водяных парах до температур 400 °С. Порошкообразный гафний пирофорен. Двуокись гафния HfO2 — белое тугоплавкое (плавится 2780 °С) вещество, обладающее высокой химической стойкостью. Двуокись гафния и соответствующие ей гидроокиси [HfO2·H2O и HfO (OH)2] амфотерны с преобладанием основных свойств. При нагревании HfO2 с щелочами и окислами щелочноземельных металлов образуются гафиаты, например Me2HfO3, Me4HfO4, Me2Hf2O5.
При нагревании гафний реагирует с галогенами, образуя соединения типа HfX4 (тетрафторид HfF4, тетрахлорид HfCl4 и др.). При высокой температуре гафний взаимодействует с углеродом, бором, азотом, кремнием, образуя металлоподобные, тугоплавкие, весьма устойчивые по отношению к химическим реагентам соединения: HfB, HfB2 (tпл 3250 °С), HfC (tпл 3887 °С), HfN (tпл 3310 °С), Hf2Si. HfSi, HfSi2. Металлический гафний растворяется в плавиковой и концентрированной серной кислотах и расплавленных фторидах щелочных металлов. Он практически не растворим в азотной, соляной, фосфорной и органических кислотах и весьма устойчив по отношению к растворам щелочей. К числу хорошо растворимых в воде соединений гафния, которые находят применение в технологии и аналитической химии гафния, принадлежат тетрахлорид и оксихлорид — HfCl4 и HfOCl2·8H2O, нитраты и сульфаты гафния — HfO (NO3)2·nH2O (n = 2 и 6), Hf (SO4)2 и Hf (SO4)2·4H2O. Для гафния характерно образование комплексов с различными органическими кислородсодержащими соединениями.
Получение и применение. Соединения гафния обычно выделяют в конце технологического цикла производства соединений циркония из рудного сырья. Металлический гафний в настоящее время получают восстановлением HfCl4 магнием или натрием. Гафний начал применяться в различных областях техники лишь недавно. Он используется в ядерной энергетике (регулирующие стержни реакторов, экраны для защиты от нейтронного излучения) и в электронной технике (катоды, геттеры, электроконтакты). Перспективно применение гафния в производстве жаропрочных сплавов для авиации и ракетной техники. Твёрдый раствор карбидов гафния и тантала, плавящийся выше 4000 °С, — самый тугоплавкий керамический материал; из него изготовляют тигли для плавки тугоплавких металлов, детали реактивных двигателей.
Лит.: Металлургия гафния, под ред. Д. Е. Томаса и Е. Т. Хейса, пер. с англ., М., 1967; Справочник по редким металлам, пер. с англ., М., 1965, с. 177—203.
Л. Н. Комиссарова.
