Аллостерическая регуляция
В качестве примера аллостерической регуляции в этом разделе рассмотрена регуляция аспартат-карбамоилтрансферазы (АКТ-азы) — ключевого фермента биосинтеза пиримидина. Аллостерические эффекты опосредуются субстратом или ингибиторами и активаторами ( аллостерическими эффекторами ). Последние связываются со специфическими участками вне активного центра и приводят к конформационным изменениям белка, попутно изменяя его активность.
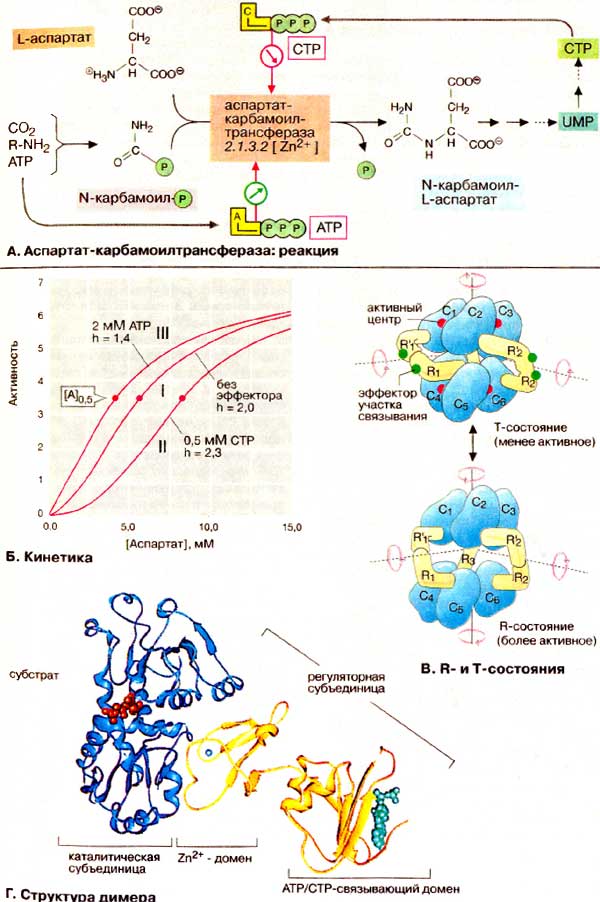
А. Аспартат-карбамоилтрансфераза: реакция
АКТ-аза катализирует перенос карбамоильного остатка с карбамоилфосфата на аминогруппу L-аспартата. Образующийся N-карбамоил-L-аспартат содержит уже все атомы будущего пиримидинового кольца. Бактериальная АКТ-аза E. coli ингибируется цитидинтрифосфатом (ЦТФ (CTP)] — конечным продуктом анаболического пути обмена пиримидина, и активируется начальным участником — АТФ (АТР).
Б. Кинетика
В отличие от изостерических (нормальных) ферментов аллостерические ферменты, такие, как АКТ-аза, имеют сигмоидную (S-образную) кривую насыщения субстратом (ср. с гемоглобином, с. 276). В аллостерических системах сродство фермента к субстрату зависит от концентрации субстрата [А]. В этом случае вместо константы Михаэлиса Km (см. с. 98) указывают концентрацию субстрата при половине максимальном скорости ([A] 0,5). Сигмоидный характер кривой описывается коэффициентом Хилла h. Для изостерических ферментов h = 1; при росте сигмоидности возрастает h.
Аллостерические эффекторы в зависимости от природы фермента влияют на максимальную скорость реакции V, концентрацию субстрата [A] 0,5 при скорости реакции, равной половине максимальной, и коэффициент Хилла h. Если изменяется преимущественно V, говорят о «V-системе». Чаще встречаются «К-системы», в которых аллостерические эффекты отражаются только на [A] 0,5 и h.
К К-типу, наряду с гемоглобином, принадлежит и АКТ-аза. Ингибитор ЦТФ вызывает в этом случае смещение кривой вправо с возрастанием [A] 0,5 и h (кривая II). Активатор АТФ, напротив, вызывает смещение влево; он уменьшает как [A] 0,5, так и h (кривая III).
В. R- и Т-состояния
Аллостерические ферменты почти всегда являются олигомерами, состоящими из 2-12 субъединиц. АКТ-аза состоит из 6 каталитических (окрашены в голубой цвет) и 6 регуляторных (окрашены в желтый цвет) субъединиц. Последние связывают аллостерические эффекторы ЦТФ и АТФ. Как и гемоглобин, АКТ-аза может существовать в двух конформациях: менее активном Т-состоянии (от англ. tense — напряженное) и более активном R-состоянии (от англ. relaxed — расслабленное). Субстрат и эффекторы влияют на равновесие между обоими состояниями и тем самым на сигмоидность кривой. С возрастанием концентрации аспартата равновесие смещается к R-форме. АТФ стабилизирует R-состояние путем связывания с регуляторной субъединицей. Напротив, присоединение ЦТФ содействует переходу в Т-состояние. Структурные перестройки между R- и Т-состояниями особенно драматичны в случае АКТ-азы. При Т→R - переходе каталитические субъединицы удаляются друг от друга на 1,2 нм; кроме того, субъединицы поворачиваются вокруг оси симметрии. При этом сами конформации субъединиц меняются незначительно.
Г. Структура димера
Каждая из двух субъединиц АКТ-азы состоит из двух доменов, т. е., независимо построенных структурных фрагментов. N-Концевой домен регуляторной субъединицы (на схеме справа) способствует взаимодействию с ЦТФ или АТФ (зеленого цвета). Zn2+-содержащий второй домен (Zn2+ — светло-голубого цвета) контактирует со смежной каталитической субъединицей. Между обоими доменами каталитической субъединицы расположен активный центр, в котором находятся два аналога, субстрата (красного цвета).
Метаболизм. Регуляция


