§ 4. Количественное определение оксида углерода (II) в крови
Содержание оксида углерода (II) в крови определяют по количеству карбоксигемоглобина. Для этой цели может быть использован спектрофотометрический метод, предложенный В. Ф. Крамаренко, Б. А. Собчуком и Т. Н. Гладышевской, который приведен в «Методических указаниях о количественном определении карбоксигемоглобина и карбоксимиоглобина» (1974).
Поступивший в организм оксид углерода (II) связывается с дезокси- и оксигемоглобином, вследствие чего образуется карбоксигемоглобин (COHb). Метгемоглобин не связывается с оксидом углерода (II) в крови. Однако в лабораторных условиях при помощи дитионита натрия (Na 2 S 2 O 4 ·2H 2 O) или других восстановителей метгемоглобин можно перевести в дезоксигемоглобин.
В ряде источников литературы дитионит натрия встречается под названием «гидросульфит натрия».
Все перечисленные выше соединения гемоглобина (дезоксигемоглобин, оксигемоглобин и карбоксигемоглобин) можно обнаружить по их спектрам поглощения в видимой области в пределах длин волн от 450 до 620 нм. Спектры поглощения оксигемоглобина и карбоксигемоглобина незначительно отличаются друг от друга. В связи с этим спектральные характеристики указанных соединений трудно использовать для их количественного определения. Значительно отличаются друг от друга спектры поглощения дезоксигемоглобина и карбоксигемоглобина. Поэтому различие этих спектров используется для количественного определения карбоксигемоглобина в крови.
Для количественного спектрофотометрического определения оксида углерода (II) по карбоксигемоглобину приготовляют ряд растворов: раствор А — раствор исследуемой крови; раствор Б — раствор крови, содержащей смесь карбоксигемоглобина и дезоксигемоглобина; раствор В — раствор крови, в которой все формы гемоглобина (дезоксигемоглобин, оксигемоглобин и метгемоглобин) полностью переведены в карбоксигемоглобин.
Чтобы избежать частичного разложения карбоксигемоглобина работа с содержащими его растворами должна производиться вдали от естественных и искусственных источников света с минимальным доступом воздуха.
Приготовление раствора А. 1 мл исследуемой трупной крови, не содержащей сгустков, вносят в мерную колбу вместимостью 100 мл и прибавляют фосфатный буферный раствор (рН = 7,38). Жидкость взбалтывают и объем ее доводят фосфатным буферным раствором до 100 мл. Полученный при этом раствор крови должен быть прозрачным.
Приготовление раствора Б. Этот раствор готовят из раствора А непосредственно в кювете спектрофотометра перед измерением оптической плотности. С этой целью в кювету вносят раствор исследуемой крови (раствор А) в таком количестве, чтобы после закрытия кюветы крышкой между ней и жидкостью не было воздуха. К раствору А, внесенному в кювету, прибавляют 3—4 мг дитионита натрия (Na 2 S 2 O 4 ·H 2 O). Содержимое кюветы тщательно перемешивают тонкой стеклянной палочкой. При этом оксигемоглобин и метгемоглобин восстанавливаются до дезоксигемоглобина, а карбоксигемоглобин с дитионитом натрия не реагирует. После прибавления дитионита натрия раствор должен быть прозрачным.
Приготовление раствора В. Этот раствор получают в специальном приборе, представленном на рис. 9. Применяемый для этой цели прибор состоит из колбы 1, закрытой пробкой, снабженной капельной воронкой 2 и отводной стеклянной трубкой для выхода оксида углерода (II) из колбы, четырех склянок Дрек-селя (3, 4, 5, 6) и отводной трубки 7. Колбу и склянки Дрекселя соединяют между собой резиновыми трубками. При отсутствии склянок Дрекселя их можно заменить колбами вместимостью 50 мл, отверстия которых закрыты пробками, снабженными двумя стеклянными трубками.
В колбу 1 вносят 50 мл концентрированной серной кислоты, а в капельную воронку 2 — 10 мл муравьиной кислоты. В склянку 3 вносят 10 %-й раствор гидроксида натрия, в склянки 4 и 6 — дистиллированную воду, а в склянку 5 — раствор А исследуемой крови в фосфатной буферной смеси. В склянки 3, 4, 5 и 6 вносят столько жидкости, чтобы трубки погружались на 2 см в жидкость.
Из капельной воронки 2 в подогретую колбу / по каплям приливают муравьиную кислоту. Интенсивность выделения оксида углерода (II) регулируют скоростью приливания муравьиной кислоты. По мере расходования муравьиной кислоты выделение газа замедляется. В начале опыта для увеличения скорости выделения оксида углерода (II) колбу осторожно нагревают на небольшом пламени газовой горелки.
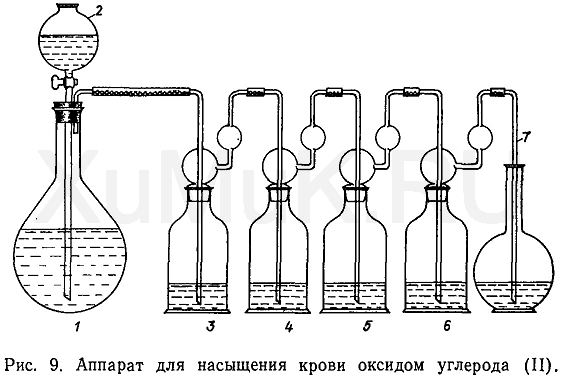
Учитывая высокую токсичность оксида углерода (II), при работе с ним необходимо соблюдать осторожность. Получение оксида углерода (II) и насыщение крови этим газом должно производиться в вытяжном шкафу с хорошей тягой.
Оксид углерода (II) из колбы 1 пропускают через склянки Дрекселя в течение 15 мин. За это время оксигемоглобин крови полностью превращается в карбоксигемоглобин. Однако при этом в растворе может оставаться некоторое количество метгемоглобина, который необходимо перевести в дезоксигемоглобин, а затем в карбоксигемоглобин. С указанной целью после пятиминутного пропускания оксида углерода (II) от прибора отсоединяют склянку 5, в которую вносят 5—7 мг дитионита натрия, и жидкость хорошо взбалтывают. (Осторожно! Не вдыхать оксид углерода (II)!). Затем склянку 5 присоединяют к прибору и в течение 5 мин пропускают оксид углерода (II). После насыщения оксидом углерода (II) раствор крови, содержащий карбоксигемоглобин, должен быть прозрачным.
При количественном определении оксида углерода (II) необходимо измерять оптическую плотность раствора крови, содержащего смесь карбоксигемоглобина и дезоксигемоглобина, а затем измерять оптическую плотность раствора крови, насыщенного оксидом углерода (II). Этот раствор не должен содержать дезоксигемоглобина, оксигемоглобина и метгемоглобина.
Дезоксигемоглобин имеет максимум светопоглощения при длине волны, равной 557 нм, а карбоксигемоглобин имеет 2 максимума светопоглощения при длинах волн 541 и 571 нм. При наложении спектральных кривых карбоксигемоглобина и дезоксигемоглобина на одном графике отмечается появление трех изобестических точек (а, б, в) при длинах волн 550, 565 и 580 нм. В этих точках пересечения спектральных кривых оптические плотности растворов карбоксигемоглобина и дезоксигемоглобина одинаковы (рис. 10).
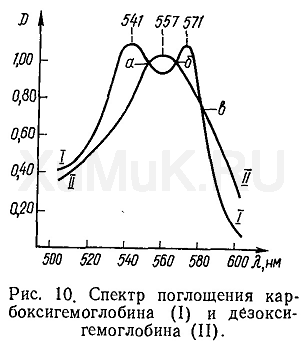
Прежде чем приступить к определению карбоксигемоглобина спектрофотометрическим методом, на графике, на который нанесены спектры поглощения карбоксигемоглобина и дезоксигемоглобина, необходимо найти длину волны, при которой расстояние между обеими спектральными кривыми (карбоксигемоглобина и дезоксигемоглобина) будет наибольшим вблизи первого максимума поглощения карбоксигемоглобина (т. е. при длине волны, равной 541 нм). На основании экспериментальных данных эта наибольшая разница значений оптических плотностей растворов карбоксигемоглобина и дезоксигемоглобина имеет место при длине волны, равной 538 нм.
В кювету спектрофотометра с толщиной слоя жидкости 1 см вносят исследуемый раствор крови (раствор А), прибавляют 3— 4 мг дитионита натрия и поступают так, как указано при описании способа получения раствора Б. Оптическую плотность этого раствора измеряют при длинах волн, равных 538 и 550 нм. Затем измеряют оптическую плотность раствора крови, в которой весь гемоглобин переведен в карбоксигемоглобин (раствор В) при длине волны, равной 538 нм. При измерении оптической плотности обоих растворов крови раствором сравнения является вода.
Приготовление сульфида аммония (см. Приложение 1, реактив 73).
Приготовление фосфатного буферного раствора для определения карбоксигемоглобина (см. Приложение 1, реактив 74).
Расчет содержания карбоксигемоглобина в исследуемой крови в процентах Ρ производят по формуле
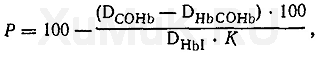
где D COHb — оптическая плотность раствора В крови, дополнительно насыщенного оксидом углерода (II) (при 538 нм); D HbCOHb — оптическая плотность раствора Б крови, обработанного дитионитом натрия, содержащего смесь дезокси- и карбоксигемоглобина (при 538 нм); D HbI — оптическая плотность раствора Б крови в изобестической точке (при 550 нм); К — коэффициент 0,372.
Величина ошибки определения карбоксигемоглобина в пределах концентраций от 3 до 20 % составляет ±3%, при концентрациях свыше 20 % погрешность примерно равняется ± 5 %.
Вариант метода спектрофотометрического определения карбоксигемоглобина в крови предложили Л. П. Букина и Л. И. Ушакова (Судебно-медицинская экспертиза, 1979, № 2). Предложенный ими вариант метода аналогичен описанному выше. Однако, согласно варианту метода, предложенного Л. П. Букиной и Л. И. Ушаковой, не требуется насыщения крови оксидом углерода (II) при каждом определении карбоксигемоглобина.
Судебно-медицинская оценка результатов количественного определения карбоксигемоглобина в крови по Г. А. Сыцянко (Научно-исследовательский институт судебной медицины МЗ СССР) приведена ниже.
Содержание карбоксигемоглобина в крови зависит прежде всего от концентрации оксида углерода (II) во вдыхаемом воздухе и времени его воздействия. Концентрация карбоксигемоглобина в крови тем выше, чем выше парциальное давление оксида углерода (II) в альвеолярном воздухе по сравнению с парциальным давлением кислорода.
За один и тот же промежуток времени при прочих равных условиях в организм поступает оксида углерода (II) тем больше, чем больше минутный объем дыхания. Симптомы, обусловленные разной коицетрацией карбоксигемоглобина в крови, тяжесть и исход отравления представлены ниже в табл. 9. Эти данные имеют ориентировочное значение.
Однако наблюдения и специальные исследования показывают, что соответствие между концентрацией карбоксигемоглобина и тяжестью отравления имеется не всегда. Это особенно отчетливо проявляется при групповых отравлениях.
Смертельная концентрация карбоксигемоглобина в крови составляет в среднем около 60 %, но может колебаться от 40 до 80 % и более. Это колебание обусловлено как влиянием внешних условий, так и особенностями организма.

Более подробно судебно-медицинская оценка результатов количественного определения карбоксигемоглобина приведена в упомянутых выше «Методических указаниях о количественном определении карбоксигемоглобина и карбоксимиоглобина».


