§ 17. Соединения марганца
Применение и токсичность соединений марганца. Соединения марганца относятся к веществам, которые в ряде случаев являются причиной отравлений. Эти соединения применяются в технике и медицине. Оксид марганца (IV), так называемый пиролюзит, находится в природе. Он является полезным ископаемым, применяемым для получения металлического марганца и его солей. При перемалывании пиролюзита на мельницах образуется пыль, которая через легкие может проникать в организм людей и вызывать отравления. Оксид марганца (IV) используется как добавка к некоторым видам сталей, для обесцвечивания стекломассы, при изготовлении линолеума и некоторых лаков. В технике применяются некоторые соли марганца для изготовления красок. Перманганат калия является окислителем. Он применяется в медицине как дезинфицирующее средство. Отмечены случаи применения перманганата калия для криминальных абортов. Некоторые соли марганца применяются в химических лабораториях как реактивы. Марганец в незначительных количествах содержится в клетках и тканях организма (см. табл. 7).
Соединения марганца относятся к числу сильных протоплаз-матических ядов. Они действуют на центральную нервную систему, вызывая в ней органические изменения, поражают почки, легкие, органы кровообращения и т. д. При использовании концентрированных растворов перманганата калия для полоскания горла может наступить отек слизистых оболочек рта и глотки.
Прием внутрь концентрированных растворов соединений марганца может быть причиной перфорации желудка. Соединения марганца могут вызвать отек голосовых связок и т. д. При попадании концентрированных растворов соединений марганца в матку, влагалище, мочевой пузырь может появиться угроза перитонита.
Соединения марганца накапливаются в печени. Они выделяются из организма через пищевой канал и с мочой. При патолого-анатомическом вскрытии трупов лиц, умерших в результате отравления соединениями марганца, отмечаются ожоги слизистых оболочек в различных участках пищевого канала, напоминающие ожоги, вызванные едкими щелочами. Обнаруживаются дегенеративные изменения в некоторых паренхиматозных органах.
Исследование минерализатов на наличие соединений марганца
Ионы марганца, содержащиеся в минерализатах, определяют при помощи реакций с периодатом калия и персульфатом аммония. После окисления ионов марганца этими реактивами образуются перманганат-ионы, имеющие фиолетовую окраску. Обе реакции являются специфичными для обнаружения ионов марганца, так как катионы других металлов при окислении указанными реактивами не дают фиолетовой окраски.
Реакция с периодатом калия КIO 4. При взаимодействии ионов марганца с периодатом калия образуется темно-красный осадок. Образование этого осадка происходит главным образом в сильно разбавленных растворах соединений марганца. В присутствии фосфатов не образуется этот осадок, а происходит окисление ионов марганца Mn 2+ до MnO 4 - :
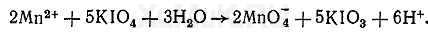
Выполнение реакции. В пробирку вносят 1 мл минерализата, 4 мл воды, 1 мл насыщенного раствора дигидрофосфата натрия и 0,2 г периодата калия. После нагревания пробирки на кипящей водяной бане в течение 20 мин при наличии ионов марганца в минерализате раствор приобретает красно-фиолетовую или розовую окраску. Предел обнаружения: 0,1 мкг марганца в 1 мл. Граница обнаружения: 0,02 мг марганца в 100 г биологического материала.
Реакция с персульфатом аммония. В зависимости от условий выполнения реакции персульфат аммония может окислять ионы марганца с образованием различных соединений. При кипячении в кислой среде без катализаторов персульфат аммония окисляет ионы марганца до марганцовистой кислоты Н 2 MnO 4 :
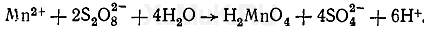
В щелочной среде без катализаторов персульфат аммония окисляет ионы марганца до MnО 2 :
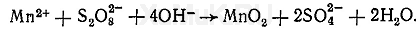
В присутствии катализаторов (соли серебра или смесь 0,1 н. растворов нитратов кобальта, никеля и ртути) персульфат аммония окисляет ионы марганца до перманганат-ионов MnO 4 - :
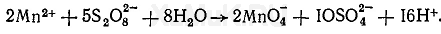
Ионы железа (III), которые могут быть в минерализатах в больших количествах, затрудняют распознавание окраски перманганатионов. Для маскировки ионов железа прибавляют фосфаты, которые с ионами железа образуют бесцветный комплекс [Fe(РО 4 ) 2 ] 3-.
Реакции окисления ионов марганца персульфатом мешают восстановители, обесцвечивающие перманганат-ионы, а также хлориды, бромиды и другие ионы, которые осаждают ионы серебра, являющиеся катализатором.
На протекание реакции персульфата с ионами марганца влияет рН среды. Эта реакция хорошо протекает в 3 н. кислоте. При недостаточной кислотности образуется темно-бурый осадок марганцовистой кислоты Н 2 MnO 4, а при большом избытке кислоты может происходить восстановление перманганат-ионов персульфатом:
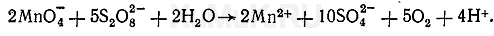
Выполнение реакции. В пробирку вносят 1 мл минерализата, 4 мл воды, 1 мл насыщенного раствора дигидрофосфата натрия. Смесь нагревают на кипящей водяной бане в течение 5—6 мин. К горячему раствору прибавляют 1 каплю 10%-го раствора нитрата серебра и 0,5 г персульфата аммония. Смесь енова нагревают в течение нескольких минут (до разложения избытка персульфата). При наличии ионов марганца в минерализате появляется красно-фиолетовая или розовая окраска. Предел обнаружения: 0,1 мкг марганца в 1 мл. Граница обнаружения: 0,1 мг марганца в 100 г биологического материала.


