Натрия гипонитрат моногидрат
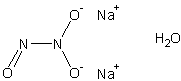
Внешний вид:
бесцветн. кристаллыБрутто-формула (система Хилла): H2N2Na2O4
Формула в виде текста: Na2N2O3 H2O
Молекулярная масса (в а.е.м.): 140
Температура разложения (в °C): 310
Способы получения:
1. Взаимодействием метилата натрия, гидроксиламина и метилнитрата в метаноле.Дополнительная информация:
Соль не выделенной в свободном состоянии азотноватой кислоты (pKa1 = 2,5, pKa2 = 9,7). Разбавленные кислоты вызывают разложение до оксида азота (I) и азотистой кислоты, концентрированные - до оксида азота (II). Действием окислителей (в том числе кислорода воздуха) легко окисляется в нитрит. В основу количественного определения положена реакция с хлоритом натрия дающая нитрат и хлорид натрия.
- Карапетьянц М.Х., Дракин С.И. "Общая и неорганическая химия" М.:Химия 1981 стр. 433
- Некрасов Б.В. "Основы общей химии" т.1 М.:Химия, 1973 стр. 425
Источники информации:
Синонимы/примеры:*
Натрия гипонитрат; Натрия нитрит; Нитрит натрия; Азотистокислый натрий
*подобраны ИИ, возможны неточности
Ещё по теме
Натрия нитрит — характеристики и использование
Натрия нитрит — свойства и применение
Натрия нитрат — свойства и применение
Натрия гипохлорит — свойства и применение
Натрия оксид — свойства и применение
