Тиомочевина
Синонимы:
тиокарбамидтиоугольной кислоты диамид
Внешний вид:
ромбические кристаллыБрутто-формула (система Хилла): CH4N2S
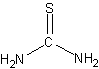
Формула в виде текста: NH2CSNH2
Молекулярная масса (в а.е.м.): 76,11
Температура плавления (в °C): 176
Температура разложения (в °C): 200
Растворимость (в г/100 г или характеристика):
бензол: не растворимвода: 4,9 (0,2°C)
вода: 9,18 (13°C)
вода: 15,2 (22,7°C)
вода: 68 (60,2°C)
вода: 200 (97°C)
диэтиловый эфир: трудно растворим
метанол: растворим 11,9 (25°C)
пиридин: растворим 12,5 (20°C)
тетрахлорметан: не растворим
этанол: растворим 4 (25°C)
Вкус, запах, гигроскопичность:
вкус: горькийСпособы получения:
1. Нагреванием роданида аммония до 170 С.2. Реакцией цианамида с сероводородом.
3. Реакцией сероуглерода с аммиаком или карбонатом аммония при 160 С.
Плотность:
1,405 (20°C, г/см3)Летальная доза (ЛД50, в мг/кг):
8000 (мыши, перорально)Применение:
Для синтеза меркаптанов, красителей, синтетических смол, лекарственных средств. Фунгицид. Ростовое вещество. Для разделения парафинов (слабо удерживает линейные молекулы, наиболее устойчивы комплексы с объемными молекулами: 2,2,4-триметилпентаном, скваленом, адамантаном). Реагент для фотометрического определения Bi, Os, Re, Ru.
Дополнительная информация:
При длительном нагревании при 130 С превращается в роданид аммония. При нагревании с щелочами гидролизуется до аммиака, сероводорода и углекислого газа. Под действием окислителей в зависимости от их природы и условий дает мочевину, формамидинсульфиновую кислоту (диоксид тиомочевины) или формамидиндисульфид, более глубокое окисление приводит к углекислому газу, серной кислоте и азоту.
Образует соли с минеральными кислотами. С солями ряда металлов дает комплексные соединения.
Легко реагирует с алкилгалогенидами, диалкилсульфатами и другими алкилирующими агентами с образованием S-алкилпроизводных изотиомочевины (S-алкилизотиурониевых солей). Последние малоустойчивы и при попытке выделения распадаются до тиолов. Аналогично тиомочевина реагирует с некоторыми спиртами (бензиловым, фурфуриловым) в присутствии соляной кислоты. S-алкилпроизводные образуются также при реакции с &bet;-лактонами и α,β-ненасыщенными кислотами. Взаимодействие тиомочевины с ацилгалогенидами или ангидридами карбоновых кислот в зависимости от температуры реакции приводит к N- или S-ацилпроизводным. S-арилирование производится с помощью активированных арилгалогенидов или арилдиазониевых солей.
При взаимодействии тиомочевины с альдегидами или кетонами образуются гидроксиалкилмочевины, которые при отщеплении воды могут быть превращены в N-тиокарбамоилимины.
Тиомочевины подвергается окислительной десульфуризации под действием сурика или окиси ртути с образованием цианамида. С нитритами металлов в присутствии кислот в зависимости от pH среды образует тиоциановую кислоту или формамидиндисульфид, при обработке дихлоридом дисеры в хлороформе дает дигидрохлорид формамидинтрисульфида, с эпоксидами образует тиираны. Реакции с бифункциональными соединениями приводят к образованию гетероциклических систем.
- "Справочник химика" т.2, Л.-М.: Химия, 1964 стр. 974-975
- "Химическая энциклопедия" т.4 М.: Советская энциклопедия, 1995 стр. 574-575
- "Химический энциклопедический словарь" под ред. Кнунянц И.Л., М.: Советсткая энциклопедия, 1983 стр. 578
