Диметилсульфат
Диметилсульфат широко применяется в технике как метилирующий агент взамен дорогостоящего иодистого (и бромистого) метила. Технически его получают перегонкой в вакууме метилсерной кислоты:
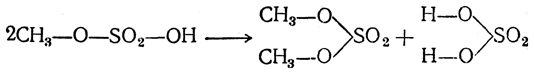
Чистый диметилсульфат — жидкость относительной плотности 1,332 (при 20°С) с показателем преломления nD20 = 1,387, кипящая при 188° С, обладающая слабым приятным запахом перечной мяты. Он чрезвычайно токсичен, причем действует не только через органы дыхания, но также быстро проникает в организм сквозь кожу. Лучшее средство для его обезвреживания при попадании на кожу — водные растворы аммиака.
Диэтилсульфат — жидкость, перегоняющаяся при атмосферном давлении около 208° С с некоторым разложением.
Реакции эфиров серной кислоты являются типичными для всех сложных эфиров сильных кислот. Они обнаруживают глубокую аналогию с реакциями галоидных алкилов. В обоих случаях главными являются реакции обмена, при которых углеводородный радикал (алкил) вводится в молекулу вместо атома металла или атома водорода. Эти реакции называются реакциями алкилирования (метилирование, этилирование и т. д.).
Аналогия реакций галоидных соединений и эфиров (кислых и средних) серной кислоты видна на следующих примерах:
1. Действие воды:
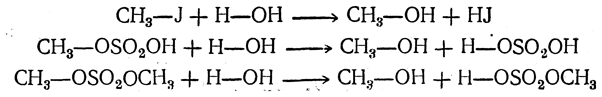
2. Действие аммиака:
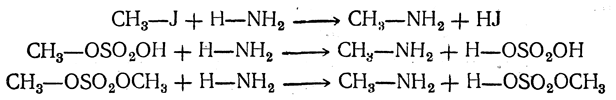
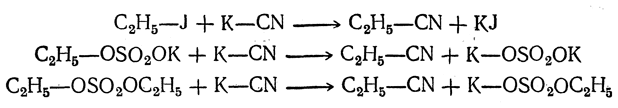
3. Действие цианидов:
4. Действие нитритов:
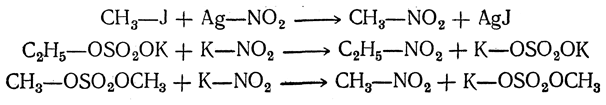
Средние эфиры серной кислоты более реакционноспособны, чем алкилсерные кислоты, в то время как галоидные алкилы занимают между ними промежуточное место. Так, например, в реакцию с нитритами метилсерная кислота вступает только при сильном нагревании, иодистый метил — при слабом нагревании (в отсутствие даже следов влаги), тогда как диметилсульфат реагирует на холоду с водным раствором нитрита калия. Это позволяет для реакций алкилирования подбирать наиболее удобный реагент для каждого случая.


