Оксиаминокислоты
В состав белков входят две β-окси-α-аминокислоты — серин и треонин.
Серин, или β-окси-α-аминопропионовая кислота, строения НО—СН2—CH(NH2)—СООН, был выделен в больших количествах в виде L-формы из клея коконов шелковичного червя (белковое вещество, называемое серицином), Серин — весьма распространенная в белках аминокислота.
Треонин (β-окси-α-аминомасляная кислота)
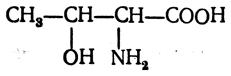
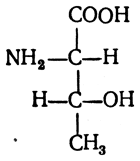
содержит два асимметрических атома углерода и поэтому образует четыре оптических антипода и два рацемата. В природе встречается только один антипод, который имеет следующую конфигурацию:
Треонин получается взаимодействием глицина с ацетальдегидом. Глицин предварительно превращают во внутрикомплексную медную соль, так как при этом резко повышается реакционная способность метиленовой группы. Активированная метиленовая группа глицина легко реагирует с карбонильной группой, например ацетальдегида, по типу альдольной конденсации:
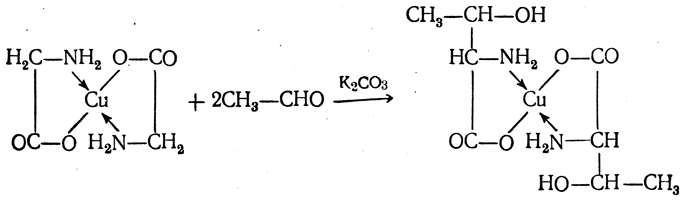
Полученную медную соль треонина разлагают сероводородом и выделяют треонин.
Аналогичным способом из медной соли глицина и формальдегида можно синтезировать серин.
Характерной особенностью β-окси-α-аминокислот является легкость окисления иодной кислотой и тетраацетатом свинца. В результате окисления, сопровождающегося разрывом углерод-углеродной связи в α,β-положении, оксиаминокислоты распадаются до альдегида (формальдегид в случае серина), аммиака и глиоксалевой кислоты:
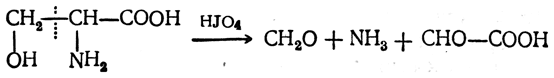
Эту реакцию дают все соединения, содержащие две гидроксильные группы или гидроксильную группу и аминогруппу у соседних атомов углерода (ср. стр. 483 и 634 сл.).


