Ацетилацетон
Ацетилацетон СН3—СО—СН2—СО—СН3 получается конденсацией уксусноэтилового эфира с ацетоном. Это — пахучая жидкость, растворимая в воде; т. кип. 137° С, относительная плотность 0,979 (при 15° С). При кипячении с водой ацетилацетон разлагается на уксусную кислоту и ацетон по уравнению
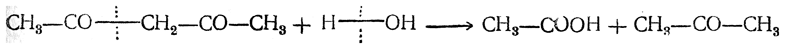
Более поздние исследования показали, что ацетилацетон не является индивидуальным веществом, а представляет собой смесь дикетона (23,6%) с изомерным ему ненасыщенным кетоноспиртом — енолом (76,4%). Оба изомера способны к обратимым взаимным превращениям
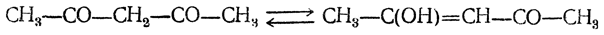
и вообще β-дикетоны находятся с ненасыщенными кетоноспиртами в отношениях таутомерии.
От енольной формы СН3—СО—СН=С(ОН)—СН3 производится ряд интересных металлических соединений ацетилацетона — ацетилацетонатов железа, меди, алюминия, бериллия, хрома, кобальта и др. Они легко образуются при смешении с ацетилацетоном свежеосажденных гидроокисей этих металлов, взвешенных в воде. Обычно сначала осадки гидроокисей переходят в раствор, из которого затем выделяются труднорастворимые ацетилацетонаты. Они легко растворимы в органических растворителях и являются неэлектролитами (или лишь очень слабо диссоциированы). Многие из них способны возгоняться и даже перегоняться без разложения. Например, ацетилацетонат алюминия Аl(С5Н7О2)3 кипит при 314° С, ацетилацетонат бериллия Be(C5H7O2)2 кипит при 270° С. Очень часто окраска этих веществ отличается от окраски обычных солей соответствующих металлов. Все указанные особенности резко отличают эти соединения от типичных солей с ионной связью между катионом металла и анионом.
Соединения ацетилацетона с металлами имеют циклическое внутрикомплексное строение
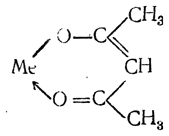
причем металл двукратно связан с каждым остатком ацетилацетона.
Такие кольцеобразные соединения получили образное название клешневидных или хелатных (от греч. хеда — клешня). Иногда в растворе может устанавливаться равновесие между ионогенной солью и хелатным соединением.


