Установление простейшей эмпирической формулы вещества на основании данных количественного элементарного анализа
По данным количественного элементарного анализа вычисляют процентный состав вещества, а по процентному составу — простейшую эмпирическую формулу соединения.
Положим, например, что при сожжении 8,676 мг вещества, содержащего углерод, водород, кислород и азот, образовалось 2,740 мг воды и 20,760 мг двуокиси углерода При определении азота из 8,872 мг того же вещества получено 0,740 мл азота при 21 °С и 752 мм рт. ст.
Так как 44 вес. ч. СО2 содержат 12 вес ч. С, то для вычисления количества углерода нужно полученный вес СО2 помножить на 12/44 или 3/11 Аналогичным образом, так как 18 вес. ч. Н2О содержат 2 вес. ч. Н, то для вычисления количества водорода нужно полученный вес воды помножить на 2/18 или 1/9. Отсюда находим, что в 8,676 мг вещества содержится
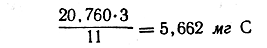
и
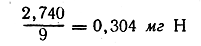
Следовательно, в 100 частях вещества содержится:
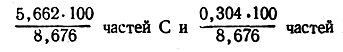
или
С —65,26 % Н —3,50 %
Вес азота вычисляется следующим образом Опытным путем найдено, что 1 мл N2 при 0 °С и 760 мм рт. cm весит 1,2507 мг В нашем опыте азот измерялся при 21 °Си 752 мм. рт. ст. Кроме того, в величину, выражающую найденный объем азота, необходимо ввести эмпирические поправки на давление водяных паров над 50%-ньм раствором КОН (над которым собирался азот) и на объем раствора едкого кали, смачивающего стенки азотометра. Эти поправки составляют в сумме 2%, и их вычитают из найденного объема азота. Таким образом, истинный объем азота в нашем случае составляет:
0,740 — 0,015 = 0,725 мл
Согласно законам Бойля — Мариотта и Гей-Люссака, вес найденного при анализе объема азота равен:
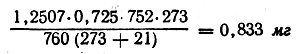
Отсюда содержание азота в веществе составляет:
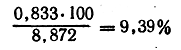
Сложив процентные содержания углерода, водорода и азота, получим 78,15%; следовательно, вещество содержит еще 21,85% кислорода. Таким образом, вещество имеет следующий состав:
65,26% С 3,50% Н; 9,39% N и 21,85% О
Если процентное содержание каждого элемента разделить на его атомный вес, то полученные величины будут обозначать соотношения, в которых соеди-нены атомы в молекуле исследуемого вещества, а именно:
5,44 С; 3,47 Н; 0,67 N; 1,36 О
Если разделить все эти величины на самую меньшую из них (0,67), получится:
8,1 С; 5,2 Н; 1 N; 2 O
Полученное соотношение атомов очень близко к формуле C8H5NO2. Процентный состав, вычисленный теоретически для этой формулы, следующий:
65,31% С; 3,40% Н; 9,52% N; 21,77% О
Если сравнить эти величины с найденными по результатам анализа, то они оказываются совпадающими в пределах ошибок, зависящих от погрешностей опыта (для обычных микроаналитических методов ±0,3%).


