§ 2. Алюминий
По распространенности в природе алюминий стоит на четвертом месте (после О, Н и Si), причем на его долю приходится около 5,5% от общего числа атомов земной коры. Главная масса алюминия сосредоточена в алюмосиликатах (X § 3). Чрезвычайно распространенным продуктом разрушения образованных ими горных пород является глина, основной состав которой (соответствующий каолину) отвечает формуле Аl2 О3 * 2SiO2 * 2H2 O. Из других минералов алюминия наибольшее значение имеют боксит (Аl2 О3 ·хН2 О) и криолит (AlF3 –3NaF).
1) Глина является основным сырьем керамической промышленности. Так называемая грубая керамика охватывает производства кирпича, различных огнеупорных (шамот и т. д.) и кислотоупорных (клинкер и т. д.) материалов, глиняной посуды (гончарное производство), изразцов, черепицы и т. д., а тонкая керамика – производство фарфора и фаянса.
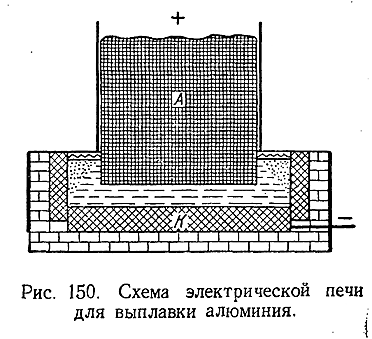
Элементарный алюминий получают электролизом раствора Аl2 О3 в расплавленном криолите. Процесс ведут при температурах около 1000°С в электрических печах, причем на аноде выделяется кислород, а на катоде – алюминий. Последний собиоается на дне печи, откуда периодически и выпускается.
Схематически показанная на рис. 150 печь для выплавки алюминия состоит из железного ящика, внутренние стенки и дно которого выложены толстой угольной обкладкой К, служащей при электролизе катодом. В качестве анода применяется массивный угольный электрод А. Во время работы печи в нее периодически добавляют Аl2 О3 , а расплавленный металл удаляют. Выплавка алюминия весьма энергоемка: каждая тонна металла требует затраты около 20 тыс. квт • ч электроэнергии.
2) Так как очистка алюминия от примесей очень трудна, необходимо, чтобы чисты были сами исходные материалы для его получения. Криолит обычно готовят искусственно, путем совместного растворения Аl(ОН)3 и соды в плавиковой кислоте по реакции
ЗNa2 СО3 + 2Аl(ОН)3 +12НF = 2Na3 AlF6 + ЗСО2 + 9Н2 О
Природные бокситы, в состав которых входит 40–60% Al2 O3 и ряд примесей (SiO2 , Fe2 O3 и т. д.), подвергают предварительной химической переработке с целью выделения из них достаточно чистой окиси алюминия (содержащей не более 0,2% SiO2 и 0,04% Fe2 O3 ). Методы такой переработки сильно зависят от состава исходного боксита и довольно сложны.
Алюминий представляет собой серебристо–белый, довольно твердый металл с плотностью 2,7, плавящийся при 660° и кипящий при 2350°С. Он характеризуется большой тягучестью и высокой электропроводностью (составляющей 0,6 электропроводности меди). С этим связано его использование в производстве электрических проводов.
Значительно более обширно применение алюминия в виде различных сплавов, наряду с хорошими механическими качествами характеризующихся своей легкостью. Особенно важен так называемый дуралюминий (приблизительный состав: 94% Аl, 4% Cu, по 0,5% Mg, Mn, Fe и Si). Он ценен тем, что при равной прочности изделия из него почти в три раза легче стальных. Не говоря уже об авиационной промышленности, для которой легкость материала особенно важна, облегчение металлических конструкций имеет громадное значение для ряда областей техники.
Это становится особенно наглядным, если принять во внимание, что, например, в груженом товарном вагоне около трети всего веса приходится на материалы, из которых изготовлен сам вагон, а в пассажирских вагонах на их собственный вес падает до 95% всей нагрузки. Очевидно, что даже частичная замена стали дуралюминием дает громадный техно–экономический эффект. В связи с этим, а также ввиду наличия в природе практически
неисчерпаемых запасов алюминия, его иногда называют «металлом будущего». Возможность широкой частичной замены им основного металла современной техники – железа – ограничивается главным образом сравнительно высокой стоимостью алюминия.
3) Кроме отмеченных областей применения алюминия, он находит широкое использование для выделки домашней посуды и т. д. При 100–150 °С алюминий настолько пластичен, что из него может быть получена фольга менее 0,01 мм толщины. Подобная фольга широко применяется для изготовления электрических конденсаторов и для завертывания некоторых продуктов. Чистая алюминиевая поверхность отражает около 90% падающего на нее излучения (не только видимого, но также инфракрасного и ультрафиолетового). Нанесением на стекло алюминия (путем напыления в вакууме) могут быть поэтому получены высококачественные зеркала, очень равномерно отражающие лучи различных длин волн. Тонкий порошок алюминия служит для изготовления устойчивой к атмосферным воздействиям серебристой краски. Ежегодная мировая добыча алюминия составляет в настоящее время около 3 млн. т (против 8 тыс. т в 1900 г.).
На воздухе алюминий тотчас покрывается тончайшей (0,00001 мм), но очень плотной пленкой окисла, предохраняющей металл от дальнейшего окисления. В связи с этим поверхность
его обычно имеет не блестящий, а матовый вид. При накаливании мелко раздробленного алюминия он энергично сгорает на воздухе. Аналогично протекает и взаимодействие его с серой. С хлором и бромом соединение происходит уже при обычной температуре, с иодом – при нагревании. При очень высоких температурах алюминий непосредственно соединяется также с азотом и углеродом. Напротив, с водородом он не взаимодействует.
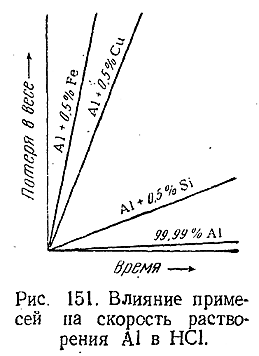
По отношению к воде алюминий вполне устойчив. Сильно разбавленные, а также очень концентрированные HNO3 и H2 SO4 на алюминий почти не действуют, тогда как при средних концентрациях этих кислот он постепенно растворяется. Чистый алюминий довольно устойчив ипо отношению к соляной кислоте, но обычный технический металл в ней растворяется (рис. 151).
Алюминий легкорастворим в сильных щелочах по реакции, например:
2Аl + 2NaOH + 2Н2 О = 2NaAlO2 + ЗН2
В ряду напряжений он располагается между Mg и Zn. Во всех своих устойчивых соединениях алюминий трехвалентен.
4) Легкость растворения алюминия в сильных шелочах обусловлена снятием с него защитной окисной пленки по схеме: Аl2 О3 + 2ОН– = 2АlO2 – +Н2 О. Так как в ряду напряжений Аl стоит значительно левее водорода, обнажение чистой поверхности металла тотчас сопровождается реакциями по схемам:
2Аl+ 6H+(из воды) = 2Аl3+ + ЗН2
и
2Аl3+ + 8ОН– = 2АlO2 + 4Н2 О
равновесие первой из них все время смещается вправо за счет второй. Аналогично протекает растворение в щелочах и других активных металлов с амфотерными гидроокисями – Sn, Zn и т. д.
Соединение алюминия с кислородом сопровождается громадным выделением тепла (399 ккал/моль Аl2 О3 ), значительно большим, чем в случае многих других металлов. Ввиду этого при накаливании смеси окисла соответствующего металла с порошком алюминия происходит бурная реакция, ведущая к выделению из взятого окисла свободного металла. Метод восстановления при помощи Аl (алюминотерми я) часто применяется для получения ряда элементов (Сг, Мn, V и др.) в свободном состоянии.
Алюминотермией иногда пользуются также для сварки друг с другом отдельных Стальных частей, в частности стыков трамвайных рельсов. Применяемая смесь («термит») состоит обычно из тонких порошков алюминия и закись–окиси железа (Fe3 O4 ). Поджигается она при помощи запала из смеси Аl и ВаO2 . Основная реакция идет по уравнению.
8Аl+ 3Fe3 O4 = 4А12 О3 + 9Fe + 795 ккал
причем развивается температура.около 3500°С.
Окись алюминия представляет собой белую, очень тугоплавкую и нерастворимую в воде массу. Природная Аl2 О3 (минерал корунд), а также полученная искусственно и затем сильно прокаленная отличается большой твердостью и нерастворимостью в кислотах. В растворимое состояние окись алюминия (т. н. глинозем) можно перевести сплавлением со щелочами.
5) Обычно загрязненный окисью железа природный корунд вследствие своей чрезвычайной твердости применяется для изготовления шлифовальных кругов, брусков и т. п. В– мелко раздробленном виде он под названием наждака служит для очистки металлических поверхностей и изготовления наждачной бумаги. Для тех же целей часто пользуются окисью алюминия, получаемой сплавлением боксита (техническое название – алунд).
Прозрачные кристаллы корунда, красиво окрашенные незначительными примесями других веществ, применяются в качестве драгоценных камней: красного рубина, синего сапфира и т. д, В настоящее время их делают искусственно путем плавления и последующей кристаллизации AI2 O3 в присутствии соответствующих примесей.
Ввиду нерастворимости Аl2 О3 в воде отвечающий этому окислу гидрат [Аl(ОН)3 ] может быть получен лишь косвенным путем (исходя из солей). Он представляет собой объемистый студенистый осадок белого цвета, практически нерастворимый в воде, но легко растворяющийся в кислотах и сильных щелочах.
Гидроокись алюминия имеет, следовательно, амфотерный характер. Однако и основные и особенно кислотные ее свойства выражены довольно слабо. В избытке NH4 OH гидроокись алюминия нерастворима.
При взаимодействии Аl(ОН)3 с сильными щелочами образуются соответствующие алюминаты, например, по схеме:
Аl(ОН)3 +КОН = КАlО2 + 2Н2 О
Алюминаты наиболее активных одновалентных металлов в воде хорошо растворимы, но ввиду сильного гидролиза растворы их устойчивы лишь при наличии достаточного избытка щелочи. Алюминаты, производящиеся от более слабых оснований, гидролизо–ваны в растворе практически нацело и поэтому могут быть получены только сухим путем (сплавлением Аl2 О3 с окислами соответствующих металлов). Большинство из них в воде нерастворимо.
6) Водные растворы алюминатов содержат ионы [Аl(ОН)4 ]–, [Al(OH)5 ]2–и [Аl(ОН)6 ]3–. По этому же типу построены, по–видимому, и алюминаты, получаемые из растворов, тогда как при сплавлении окислов образуются безводные соли, по своему составу производящиеся от HAlO3 .
С кислотами Аl(ОН)3 образует соли, содержащие в растворе бесцветные ионы Аl3+. Производные большинства сильных кислот хорошо растворимы в воде, но довольно значительно гидролизованы и поэтому растворы их показывают кислую реакцию. Еще сильнее гидролизованы растворимые соли Аl3+ и слабых кислот.
В ряду галогенидов алюминия AlF3 сильно отличается по свойствам от своих аналогов. Полученный сухим путем (например, накаливанием Аl2 О3 в парах HF) фтористый алюминий представляет собой бесцветный кристаллический порошок, плавящийся лишь при 1040 °С. В воде он практически нерастворим.
Соединения алюминия с хлором, бромом и иодом бесцветны и легкоплавки. Они весьма реакционноспособны и хорошо растворимы не только в воде, но и во многих органических растворителях. В водном растворе все они сильно гидролизованы. Будучи заметно летучими уже при обычных условиях, AlCl3 , АlВr3 и AlJ3 дымят во влажном воздухе (вследствие гидролиза).
С галоидными солями ряда одновалентных металлов галогениды алюминия образуют комплексные соединения, главным образом типов M3 [AlF6 ] и М[АlГ4 ] (где Г = Сl, Вr или J). Склонность к реакциям присоединения вообще сильно выражена у рассматриваемых галогенидов, особенно у АlСl3 . Именно с этим связано его важнейшее техническое применение в качестве катализатора (при переработке нефти и при органических синтезах).
7) Некоторые константы галогенидов алюминия сопоставлены ниже:

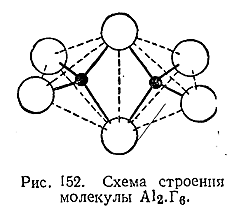
Плотности паров АlCl3 , АLВr3 и АJз при сравнительно невысоких температурах более или менее точно соответствуют удвоенным формулам – Аl2 Г6 . Пространственная структура этих молекул отвечает двум тетраэдрам с общим ребром (рис. 152). Каждый атом алюминия связан с четырьмя атомами галоида, а каждый из центральных атомов галоида – с обоими атомами алюминия. Из двух связей центрального галоида одна является донорно–акцепторной (IX § 2 доп. 1), причем алюминий функционирует в качестве акцептора.
Сернокислый алюминий бесцветен и легкорастворим в воде. Выделяется он обычно в виде кристаллогидрата Al2 (SО4 )з ·18Н2 О. С сульфатами ряда одновалентных металлов сернокислый алюминий образует бесцветные комплексные соли типа M[Al(SO4 )2 ] ·12Н2 О. Будучи вполне устойчивы в твердом состоянии, эти соли (т. н. квасцы) в растворе почти нацело диссоциированы на отдельные составляющие их ионы. Помимо алюминия, комплексные сульфаты типа квасцов известны и для ряда другихтрехвалентных металлов (Э = Сr, Fe, V и др.). В качестве одновалентных катионов (М) в их состав могут входить К+, Na+, NH4 +и некоторые другие.
Из остальных производных алюминия следует упомянуть его уксуснокислую соль [Al(СН3 СОО)3 ], используемую при крашении тканей (в качестве протравы) и в медицине (примочки и компрессы). Соль эта известна только в растворе (где сильно гидролизована). Азотнокислый алюминий легкорастворим в воде. Фосфорнокислый алюминий нерастворим в воде (и уксусной кислоте), но растворим в сильных кислотах и щелочах.
8) Сульфид алюминия (AI2S3) может быть получен взаимодействием элементов и представляет собой белые иглы (т. пл. 1100 °С). С азотом порошкообразный алюминий соединяется выше 800 °С. Нитрид алюминия (AlN) представляет собой белый порошок, не изменяющийся при нагревании приблизительно до 2000 °С, а выше этой температуры начинающий распадаться на элементы. Водой он медленно разлагается по уравнению:
AlN + 3H2 O = Al(OH)3 + NH3
Желтый карбид алюминия (Аl4 С3 ) образуется при нагревании смеси окиси алюминия и угля приблизительно до 2000 °С. Вода разлагает его по уравнению: Аl4 С3 +12Н2 О = 4Аl(ОН)3 + ЗСН4 .
9) Хотя с водородом алюминий химически не взаимодействует, однако косвенным путем в виде белой аморфной массы можно получить гидрид алюминия. Он представляет собой сильно полимеризованный продукт состава (АlН3 )x . При нагревании выше 100 °С гидрид алюминия разлагается на элементы.


