Азота фториды
АЗОТА ФТОРИДЫ, бесцв. газы со специфич. запахом (см. табл.). Термически неустойчивы (кроме NF3 и NOF), при 100-300°С разлагаются (NHF2 и NC1F2-взрываются): N2F4-сначала до NF2, затем до NF3 и N2; N2F2 -до F2 и N2 (выше 70°С); NHF2 - на N,F4 и NH4HF2; NClF,-Ha N2F4 и Сl2 или NF3, N2 и C12; NO2F- на O2 и NOF; NOF3-Ha F2 и NOF. Гидролизуются водой, причем NF3 и NHF2 раств. в воде и медленно гидролизуются в р-ре, N2F4 и N2F2 гидролизуются при нагревании. NOF и NO2F раств. в жидком HF с образованием гидрофторидов: NOF-3HF (т. пл. 1°С, т. кип. 95 °С), NOF-6HF (т. кип. 69°С), 2NO2F-7HF (т. пл. -28°С), NO,F-4HF (т. пл. -39°С), 4NO2F-21HF (т.пл. -67°С), 3NO2F-20HF (т. пл. -96°С).
Азота фториды - сильные окислители. Взаимод. со мн. элементами, оксидами, солями, орг. и элементоорг. соединениями. Смеси наиб. инертного азота фторида - NF3 с газами-восстановителями или парами Н2О при нагр. взрываются. Азота фториды присоединяются к олефинам, с к-тами Льюиса образуют комплексные соед., содержащие катионы NF4+ N2F+ , N2F3+, NOF+2, NH2F+2 и др.
Методы получения азота фторидов: NF3-электролизом расплавов NH4HF2-HF или взаимод. F2 с NH3 либо с NH4HF2; N2F4 - реакцией NF3 с С или металлами; NHF2 -фторированием водных р-ров мочевины с послед, гидролизом образовавшегося NH2NONF2 при 50-60°С; NC1F2 - взаимод. F2 с NaN3 в присут. NaCl или взаимод. F2 и С12 с NaN3; N2F2 - р-цией F2 с NaN3 или NHF2 с KF, а также как побочный продукт при синтезе NF3; NOF и NOF3 - взаимод. NO с F2; NO2F- взаимод. F2 с NO2 или NaNО2.
Азота фториды применяют как окислители и фторирующие агенты; NOF и NO2F-перспективные р-рители (напр., в технологии ядерного топлива), NOF-низкотемпературный электролит; N2F4 и N2F2-перспективные окислители ракетного топлива.
СВОЙСТВА ФТОРИДОВ АЗОТА
| Показатель | Трифторид азота NF3 | Тетрафтор-гидразин N2F4 | Дифтордиазии N2F2 | Нитрозил- NOF | Нитрилфторид NO2F | Трифтор-аминоксид NOF3 | Дифторамин NHF2 | Хлороди-фторамин NC1F2 |
| транс- *цис-изомер изомер | ||||||||
| Т. пл, °С ....... | -206,78 | -161,5 | - 172 выше -195 | - 132,5 | - 166,0 | -160 | -11,8 | -190,5 |
| Т. кип., °С ....... | - 129.00 | -74,2 | -111,4 -105,7 | -59,9 | -72.4 | -85 | -23,3 | -65,9 |
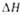 пл, кДж/моль ..... пл, кДж/моль ..... | 0,397 | |||||||
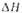 исп, кДж/моль | 11.6 | 15,7 | 14,2 15,3 | 19 | 18 | 16,1 | 24,9 | 17,4 |
| Плотность жидкости, т/см3 . | 1,643 (-154°C) | 1,454 (-74,2°C) | — — | 1,326 (-59,9°С) | 1,492 (-72,4°C) | 0,927 (-87,6°С) | 1,373 (-23,6°C) | - |
| С°, ДжД.моль*К) . . . . | 53,53 | 88,4 | 53,4 54,5 | 41,5 | 49,09 | 68,1 | 43,38 | 59.3 |
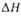 обр, кДж/моль .... обр, кДж/моль .... | -131,7 | -22 | 67,3 62 | 65,0 | -109 | -187 | -103 | 17 |
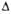 G0обр, кДж/моль .... G0обр, кДж/моль .... | -84 | 79 | 140 139 | -51 | 37 | -49 | 54 | |
| S0298, Дж/(моль*К) . . . . | 260,7 | 317 | 262,0 266,3 | 248 | 259,3 | 277,6 | 252,7 | 284 |
*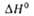 перехода t/uc-формы в транс-форму 5,6 ± 1,0 кДж/моль.
перехода t/uc-формы в транс-форму 5,6 ± 1,0 кДж/моль.
Помимо перечисленных известны и др. азота фториды - фторамины NH2F и ND2F, дихлорофторамин NC12F. Иногда к азота фторидам относят также азид фтора N3F и нитроксифторид NO3F.
