Урана фториды
УРАНА ФТОРИДЫ: UFx, где х = 6, 5, 4 и 3, U2F9 и U4F17, UOF4, UO2F2, UOF2 и др. оксифториды, гексафтороурановая к-та HUF6·nH2O и др., фтороуранаты, напр. Na2Ur8. Многие урана фториды при 200-400 0C разлагаются с выделением UF6, по схемам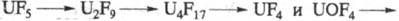
В технологии урана UF6 и UF4 - ключевые в-ва; UO2F2 и нек-рые комплексные урана фториды- промежуточные в-ва отдельных стадий произ-ва.
Гексафторид UF6 (табл.) легко возгоняется и дымит во влажном воздухе; ур-ние температурной зависимости давления пара над твердым UF6 lgp(Пa) = 23,99593 - 3123,479/Т-3,77962lgT, над жидким - lg р(Па) = 20,724933 -2065,679/T- 3,72662 lg T; раств. в орг. р-рителях, жидком HF. Гидролизуется водой и ее парами до UO2F2; взаимод. с MF, где M = Li, Na, К, NH4+, NO+ и др., нек-рыми MF2, образуя фтороуранаты (Vl); при натр, восстанавливается H2, NH3, CCl4 до UF4. Его получают взаимод. UF4, реже оксидов U, с F2 (в пром-сти р-цию проводят в пламени смеси H2 и F2), очищают ректификацией. UF6 используют при разделении изотопов U методами газовой диффузии и центрифугирования, как исходное в-во в произ-ве UO2 для твэлов.
ХАРАКТЕРИСТИКА ФТОРИДОВ УРАНА
| Показатель | UF6 | a-UF5 | b-UF5 | U2F9 | UF4 | UF3 | UO2F2 | UOF4 | ||
| Цвет | Желтоватый | Голубоватый | Голубоватый | Черный | Зеленый | Красновато-фиолетовый | Желтый | Желтый | ||
| Сингония | Ромбич. | Тетрагон. | Тетрагон. | Кубич. | Моноклиннаяб | Гексаген. | Тритонг | Тетрагон. | ||
| Параметры решетки, нм: | | |||||||||
| а | 0,9924 | 0,6525 | 1,1473 | 0,8462 | 1,1273 | 0,7179 | 0,5754 | 1,14743 | ||
| b | 0,8954 | — | — | — | 1,0753 | — | — | — | ||
| с | 0,5198 | 0,4472 | 0,5208 | — | 0,8404 | 0,7345 | — | 0,52043 | ||
| Число формульных единиц в ячейке | 4 | 2 | 8 | 4 | 12 | 1 | 1 | 8 | ||
| T. пл., 0C | 64,0 а | 348 | Разл. | Разл. | 1036в | 1500 | 1030 | Разл. | ||
| Плотн., г/см3 | 5,06 | 5,81 | 6,45 | 7,09 | 6,72 | 8,54 | 6,44 | 6,40 | ||
| | 167 | 134 | — | — | 115,9 | — | 103 | — | ||
| | -2197 | -2079 | -2071 | -4014 | -1920 | -1508 | -1660 | — | ||
| | 227,6 | 188 | — | — | 151,7 | 117 | 135 | — | ||
а T. возг. 56,50C; 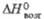 48,07 кДж/моль (56,5 0C). б b = 126,33°. в T. кип. 1730 0C. г a = 42,73°.
48,07 кДж/моль (56,5 0C). б b = 126,33°. в T. кип. 1730 0C. г a = 42,73°.
Тетрафторид UF4 гигроскопичен, образует кристаллогидраты; плохо раств. в воде (1,6· 10-4 моль/л), лучше в к-тах, разлагается р-рами карбонатов металлов. При нагр. во влажном воздухе подвергается окислению и пирогидролизу до U3O8 и UO2F2, в O2 в присут. катализатора образует UF6 и UO2F2; восстанавливается H2 до UF3, Ca, Mg - до U. Его получают осаждением из р-ров U4+ с послед, сушкой и прокаливанием, взаимод. UO2 с газообразным HF при 300-500 0C, восстановлением UF6 в пламени смеси H2 - F2 или орг. в-вами, м. б. получен термич. разложением (NH4)2UF6 или NH4UF5.
Уранилфторид UO2F2 при нагр. выше 800 0C разлагается до UF6, U3O8 и O2 с частичной возгонкой; гигроскопичен, образует кристаллогидраты; хорошо раств. в воде (ок. 65% по массе при 25 0C); получают гидролизом или пирогидроли-зом UF6, взаимод. UO3 с газообразным HF.
Лит.: Химия и технология фтористых соединений урана, M., 1961; Химия фтористых соединений актинидов, M., 1963; Гагаринский Ю. В., Хри-пин Л. А., Тетрафторид урана, M., 1966; Щербаков В. И., Зуев В. А., Парфенов А. В., Кинетика и механизм фторирования соединений урана, плутония, нептуния фтором и галогенфгоридами, M., 1985; Зуев В.А., Орехов В.Т., Гексафториды актиноидов, M., 1991; Химия актиноидов, под ред. Дж. Каца. Г. Сиборга, Л. Мореса, пер. с англ., M., 1991. Э. Г. Раков.

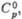 Дж/(
Дж/(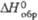 , кДж/моль
, кДж/моль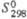 ,Дж/(моль·К)
,Дж/(моль·К)